
| A、用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 |
| B、用焰色反应鉴别NaCl固体和NaOH固体 |
| C、用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| D、用丁达尔效应鉴别NaCl溶液和KCl溶液 |


科目:高中化学 来源: 题型:
| A、①与d | B、②与a |
| C、③与c | D、④与b |
查看答案和解析>>
科目:高中化学 来源: 题型:
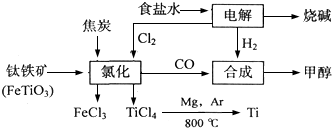
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B、点燃这种液体,然后再观察火焰的颜色 |
| C、先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| D、加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸、硫酸 |
| B、盐酸、NaOH溶液 |
| C、氨水、硫酸 |
| D、氨水、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有部分未反应的乙酸被蒸馏出来 |
| B、有部分未反应的乙醇被蒸馏出来 |
| C、产品中有被蒸馏出的H2SO4 |
| D、有部分乙醇跟浓H2SO4作用生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl、CuSO4、Mg(NO3)2、KOH |
| B、NaBr、AgNO3、HCl、Na2CO3 |
| C、H2SO4、NaCl、Na2SO4、Na2CO3 |
| D、NaOH、MgSO4、Na2CO3、KHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
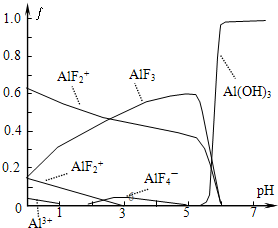 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com