
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 在一体积为10L的容器中,通入一定量的CO和H2O在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度的变化如图.
在一体积为10L的容器中,通入一定量的CO和H2O在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度的变化如图.查看答案和解析>>
科目:高中化学 来源: 题型:

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |

| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下:
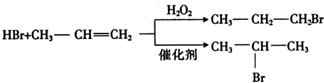
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )
向20mL 0.1mol?L-1氨水中逐滴加入0.1mol?L-1稀HCl,混合液pH与所加盐酸体积(V/mL)的关系如图所示.下列说法正确的是( )| A、在D点:c(NH4+)+c(NH3?H2O)>c(Cl-) | ||||
| B、在C点,有V1>10,且c(NH4+)c(Cl-)>c(OH-)=c(H+) | ||||
| C、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||||
D、由B到C的过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 |
| B、钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用 |
| C、14C与12C互称同位素;O2与O3是氧元素的同素异形体 |
| D、SO2和CO2属于酸性氧化物,Na2O和Al2O3属于碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置用于分离CCl4和H2O的混合物 |
B、 装置用于收集H2、CO2、Cl2等气体 |
C、 装置用于吸收NH3或HCl,并防止倒吸 |
D、 装置用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基
是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基
| CrO3/H2SO4 |
 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
查看答案和解析>>
科目:高中化学 来源: 题型:
 在3支试管中分别放有:①1mL苯和3mL水;②1mL溴苯和3mL水;③1mL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL苯和3mL水;②1mL溴苯和3mL水;③1mL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )| A、①②③ | B、①③② |
| C、②①③ | D、②③① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com