
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
分析 A.煤、石油、天然气属于化石燃料,燃烧时放出大量的热;
B.光合作用是将太阳能转化为化学能的过程;
C.吸热反应可以为人类所利用.
D.根据能量之间的相互转化知识来判断.
解答 解:A.煤、石油、天然气属于化石燃料,燃烧时放出大量的热,可说明其物质内部蕴藏着大量的能量,故A正确;
B.绿色植物进行的光合作用是将太阳能转化为化学能“贮存”起来的过程,故B正确;
C.吸热反应原理可以为人类利用,如“摇摇冰”的上市就是利用了吸热反应原理,故C错误;
D.化学反应中,化学能可转变为多种形式的能量,如物质燃烧时将化学能转化为热能,原电池就是将化学能转化为电能的装置,故D正确.
故选C.
点评 本题考查反应热与焓变,为高频考点,能源、信息、材料、环境是当今世界四大首要问题,在能源危机日趋严重的今天,它既是社会热点,也是化学考查的热点,主要侧重能源的分类、能源使用对环境的影响、新能源开发的技术和前景等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸、Na2CO3•10H2O、Ca(OH)2 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、生石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
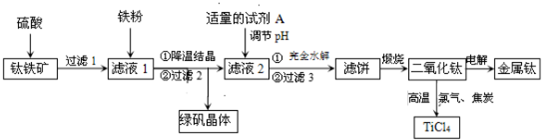
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
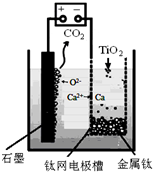
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
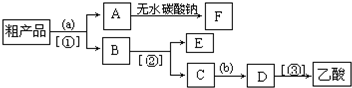
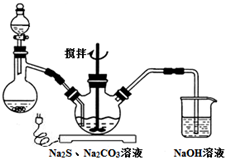 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com