
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
分析 元素周期律的实质为元素的性质随原子序数的周期性变化、原子结构的周期性质变化而出现周期性的变化,以此来解答.
解答 解:A.因原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化,故A正确;
B.元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故B正确;
C.周期表中O、F没有正价,则第二周期不会出现元素的最高化合价从+1到+7,故C错误;
D.在同周期、同主族元素的性质均随原子序数发生周期性的变化,则元素的金属性和非金属性随原子序数的递增呈现周期性变化,故D正确;
故选C.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素周期律的实质及元素性质的周期性变化为解答的关键,注重基础知识的考查,题目难度不大.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CHCH3,分子中的四个碳原子在同一直线上 | |
| B. | 乙醛能使溴水出现褪色觋象,是因为乙醛发生了氧化反应 | |
| C. | 在酸性条件下,CH3CO18OCH2CH3的水解产物是CH3COOH和CH3CH218OH | |
| D. | 聚合物(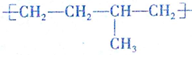 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 乙醇与浓硫酸在140℃时共热:CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$ | |
| D. | 用18O标记的乙醇与乙酸发生酯化反应:C2H518OH+CH3COOH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、2H、3H互为同素异形体 | |
| B. | 碳酸氢钠和纯碱是同一物质 | |
| C. | 乙醇(CH3CH2OH)与甲醚(CH3OCH3)互为同分异构体 | |
| D. | O2与O3互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 利用如图装置可验证同主族元素非金属性的变化规律.
利用如图装置可验证同主族元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgO制取Mg | |
| B. | 加热条件下用CO还原Ag2O制取Ag | |
| C. | 在A1和F2O3反应中,生成11.2gFe,转移电子数为0.6NA | |
| D. | 电解NaCl溶液制取Na |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
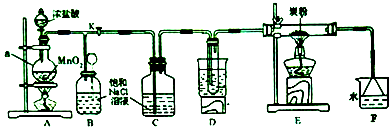
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com