
【题目】下列各离子方程式中,属于水解反应的是
A. HCO3-+H2O H3O++CO32- B. NH3+H2O OH-+NH4+
C. AlO2- + 2H2O Al(OH)3 + OH- D. CO32-+H3O+ = H2O+HCO3-
【答案】C
【解析】
HCO3-+H2O H3O++CO32-是HCO3-的电离方程式;NH3+H2O OH-+NH4+是电离方程式;AlO2- 结合水电离的氢离子生成氢氧化铝;CO32-+H2O HCO3-+ OH-是CO32-的水解方程式。
HCO3-+H2O H3O++CO32-是HCO3-的电离方程式,HCO3-水解方程式是HCO3-+H2O H2CO3+OH-,故A错误;NH3+H2O OH-+NH4+是NH3![]() H2O的电离方程式,故B错误;AlO2- 结合水电离的氢离子生成氢氧化铝,AlO2- + 2H2O Al(OH)3 + OH-是水解方程式,故C正确;CO32-的水解方程式是CO32-+H2O HCO3-+ OH-,故D错误;选C。
H2O的电离方程式,故B错误;AlO2- 结合水电离的氢离子生成氢氧化铝,AlO2- + 2H2O Al(OH)3 + OH-是水解方程式,故C正确;CO32-的水解方程式是CO32-+H2O HCO3-+ OH-,故D错误;选C。


科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。

①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是_______________________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4 ·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C. 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和化学平衡影响的图象,其中图象和实验结论表达错误的是

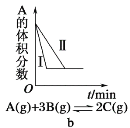

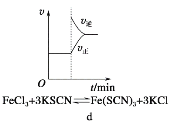
A. a是其他条件一定时,反应速率随温度变化的图象,正反应ΔH > 0
B. b是在有无催化剂存在下建立的平衡过程图象,Ⅰ是使用催化剂时的曲线
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 0.5mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法错误的是
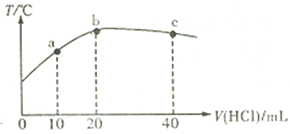
A. 从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+)
B. 由水电离的c(H+):b点>c点
C. NH3·H2O的电离程度:b点>a点
D. b点到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入___________滴定管中。(填“甲”或“乙”)
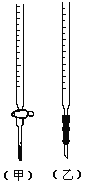
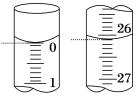
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________________________,滴定终点的现象为_______________。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为___________mL,所用盐酸溶液的体积为___________________mL。
(4)某学生根据3次实验分别记录有关数据如表所示:
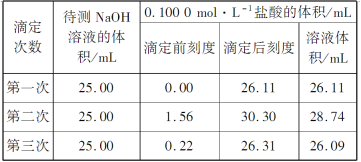
依据表中数据计算该NaOH溶液的物质的量浓度________________。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是
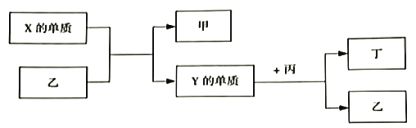
A. 原子序数由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都能形成两种或两种以上的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种非金属元素(除H外),A、B在反应中各结合1个电子,形成稳定结构,与氢气化合产物的稳定性,B>A;原子序数C>D,C、D的稳定结构的核外电子数与A的稳定结构的核外电子数相等,则四种元素的非金属性由强到弱的排列顺序正确的是( )
A.A、B、D、CB.B、A、D、CC.A、B、C、DD.B、A、C、D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com