
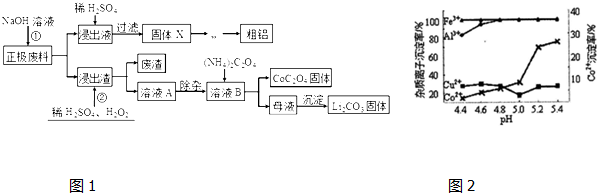
分析 正极废料中含有LiCo02、铝、炭黑,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,在浸出液中加入稀硫酸生成氢氧化铝,过滤得到氢氧化铝,灼烧、电解可得到铝;滤渣为LiCo02、炭黑等,将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,反应的离子方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,题给信息可知A溶液主要的金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+,经除杂后加入草酸铵,可得到CoC2O4固体,母液中含有Li+,加入饱和碳酸钠溶液后过滤,最后得到碳酸锂固体,
(1)Al与氢氧化钠反应生成偏铝酸根离子和氢气;偏铝酸根离子与二氧化碳、HCl等酸性溶液均能反应生成氢氧化铝沉淀;
(2)过氧化氢、LiCoO2和硫酸反应生成Li2SO4、CoSO4、氧气和水;反应中化合价升高的作还原剂;
(3)调节pH时Co2+不生成沉淀,而Fe3+、Al3+生成沉淀;
(4)由流程分析判断;
(5)1000 g锂离子电池正极材料(Li元素含量为5%),回收率为84%,可以求出Li的质量和物质的量,根据Li元素守恒计算Li2CO3的质量.
解答 解:(1)铝能与碱反应生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠溶液加入稀硫酸,可生成Al(OH)3沉淀,也可以用其它酸代替硫酸,如盐酸、二氧化碳等,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;BC;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,反应中Co元素化合价降低,O元素化合价升高,H2O2为还原剂,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;H2O2;
(3)由图2可知,当调节pH<5.0时,Co2+不生成沉淀,而Fe3+、Al3+易生成沉淀而除去,可除去杂质离子是Fe3+、Al3+,
故答案为:Fe3+、Al3+;
(4)由流程可知,经分离、提纯后,母液中含有Li+、NH4+、SO42-等离子,
故答案为:Li+、NH4+、SO42-;
(5)1000g锂离子电池正极材料中Li的质量为1000g×5%=50g,回收的质量为50g×84%=42g,n(Li)=$\frac{42g}{7g/mol}$=6mol,
则n(Li2CO3)=3mol,m(Li2CO3)=3mol×74=222g,
故答案为:222g.
点评 本题考查了物质分离提纯实验方案设计,侧重于学生的分析能力的考查,题目涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
 ,与过量的酸性KMnO4溶液作用,得到下列三种化合物:
,与过量的酸性KMnO4溶液作用,得到下列三种化合物: 、
、 和
和 .化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )
.化合物乙是甲的同分异构体,乙与过量的酸性KMnO4溶液作用,得到和甲相同的产物.乙的结构简式为( )| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、硫、氯及其化合物是中学化学重要的组成部分.
氮、硫、氯及其化合物是中学化学重要的组成部分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氧气的一极是负极 | |
| B. | 放电时,溶液中的OH-向正极移动 | |
| C. | 反应中若有6mol电子发生转移,则有32g CH3OH被还原 | |
| D. | 该电池工作时甲醇一极附近溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
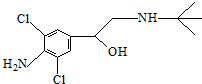
| A. | 该物质在一定条件下可发生消去反应和酯化反应 | |
| B. | 该物质分子中含有6个饱和碳原子 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多需NaOH 2 mol | |
| D. | 该物质的分子式为C12H18ON2Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应.
CH3COOCH2CH3+H2O.该反应类型是酯化(取代)反应. .
. +4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+
+4NaOH$\stackrel{△}{→}$$→_{△}^{NaOH}$CH3COONa+ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
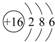 ;④的离子结构示意图
;④的离子结构示意图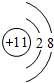 .
.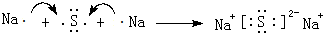 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2微溶于水,易溶于CCl4;HCl易溶于水 | |
| B. | 在水中的溶解度:C2H5OH>CH3CH2CH2CH2OH | |
| C. | 不同的烃之间相互溶解 | |
| D. | I2易溶于KI溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com