
 ,其六氯代物有3种;
,其六氯代物有3种;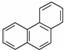 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种; ),其二氯代物有16种.
),其二氯代物有16种. 分析 ①醇的同分异构体:先考虑碳架异构,再考虑位置异构;醚的同分异构体:利用形成醚的醇的同分异构体来确定;
②分子式为C6H12的烯烃,含有1个C=C双键,分子结构中含有3个“-CH3”原子团,可以看做3个甲基取代丙烯中的3个H原子,结合丙烯的结构确定甲基的可能位置书写判断;
③分子式为C5H10O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为5,讨论羧酸与醇含有的碳原子,判断形成该酯的羧酸与醇的同分异构体种数,根据羧酸与醇组合,计算同分异构体数目;
④采用换元法,将氯原子代替氢原子,氢原子代替氯原子,从二氯代物有几种同分异构体,就可得到六氯代物也有几种同分异构体;
⑤利用对称性来分析几种位置的H原子,即可确定一氯代物的同分异构体数目, 二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断;
二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断;
⑥利用对称性来分析几种位置的H原子,即可确定一氯代物的同分异构体数目, 二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,还可以取代甲基上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断;
二氯代物可以取代同一苯环上的氢原子,可以取代不同苯环上的氢原子,还可以取代甲基上的氢原子,定其中1个氯原子位置,移动另一氯原子,书写判断;
解答 解:①分子式为C5H12O醇的同分异构体:
主链五个碳的有3种:CH2(OH)CH2CH2CH2CH3、CH3CH(OH)CH2CH2CH3、CH3CH2CH(OH)CH2CH3;
主链四个碳的有4种:CH2(OH)CH(CH3)CH2CH3、CH3C(OH)(CH3)CH2CH3、CH3CH(CH3)CH(OH)CH3、CH3CH(CH3)CH2CH2(OH);
主链三个碳的有1种:C(CH3)3CH2OH
分子式为C5H12O醚的同分异构体:
甲丁醚有4种:CH3OCH2CH2CH2CH3、CH3OCH(CH3)CH2CH3、CH3OCH2CH(CH3)CH3、CH3OC(CH3)3
乙丙醚有2种:CH3CH2OCH2CH2CH3、CH3CH2OCH(CH3)CH3;
故答案为:14;
②分子式为C6H12的烯烃,含有1个C=C双键,分子结构中含有3个“-CH3”原子团,可以看做3个甲基取代丙烯中的3个H原子,符合条件的结构有:CH2=CHC(CH3)3、CH2=C(CH3)CH(CH3)2、CH3CH=CHCH(CH3)2、CH3CH=C(CH3)CH2CH3、(CH3)2C=CHCH2CH3,故共有5种;
故答案为:5;
③分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,属于饱和一元酯,
若为甲酸和丁醇酯化,丁醇有4种;
若为乙酸和丙醇酯化,丙醇有2种;
若为丙酸和乙醇酯化,丙酸有1种;
若为丁酸和甲醇酯化,丁酸有2种;
故羧酸共有5种,醇共有8种,酸和醇重新组合可形成的酯共有5×8=40种;
故答案为:40;
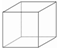
④立方烷有8个H原子,其中2个H原子被氯原子取代形成立方烷的二氯代物,六氯代物可以看作C3Cl8中的8个氯原子,其中2个氯原子被2个氢原子代替形成,两者是等效的,氯代物有3种同分异构体,可得到六氯代物也有3种同分异构体;
故答案为:3;
⑤菲的结构中共有5种氢原子,一氯代物有5种: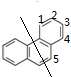 ,
,
当氯原子取代1位时 ,故此时二氯代物有9种;
,故此时二氯代物有9种;
当氯原子取代2位时 ,故此时二氯代物有7种;
,故此时二氯代物有7种;
当氯原子取代3位时 ,故此时二氯代物有5种;
,故此时二氯代物有5种;
当氯原子取代4位时 ,故此时二氯代物有3种;
,故此时二氯代物有3种;
当氯原子取代5位时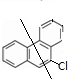 ,故此时二氯代物有1种;
,故此时二氯代物有1种;
故总共有:9+7+5+3+1=25种,
故答案为:25;
⑥ 共有3种氢原子,一氯代物有3种:
共有3种氢原子,一氯代物有3种: ,
,
当氯原子取代1位时,故此时二氯代物有6种;
当氯原子取代2位时,故此时二氯代物有7种;
当氯原子取代3位时,故此时二氯代物有3种;
故总共有:6+7+3=16种,
故答案为:16;
点评 本题考查同分异构体的书写与判断,掌握对应方法是解题的关键,注意一氯代物利用等效氢判断,二元取代采取定一移一法,注意重复、漏写,难度较大.


科目:高中化学 来源: 题型:多选题
| A. | 反应②中Cu2S只发生了氧化反应 | |
| B. | 反应①中氧化产物只有SO2 | |
| C. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA | |
| D. | 将1molCu2S冶炼成2molCu,需要O21mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 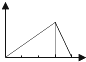 | B. | 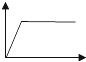 | C. | 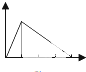 | D. |  | ||||
| E. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P是氧化剂 | B. | 氧化性H2O2>Na2H2P2O6 | ||
| C. | 1mol H2O2反应,转移电子1mol | D. | Na2H2P2O6中磷元素的化合价为+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 彩色密封塑胶袋能造成白色污染 | |
| B. | 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠 | |
| C. | 化学变化都伴随着能量的变化 | |
| D. | 大多数合金比各成分金属硬度小,熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓HNO3:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
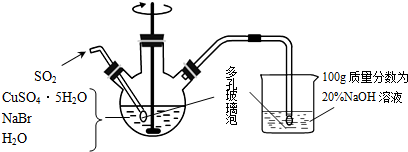
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com