
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A、30 g SiO2含有NA个Si-O共价键
B、1 L 0.2mol·L-1 Al2(SO4)3溶液中的离子总数为NA
C、标准状况下,22.4 L H2O所含原子个数大于3NA
D、含4 mol HCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA
【知识点】阿伏加德罗常数的有关计算
【答案解析】C 解析:A、一个二氧化硅含有4个Si一O键,1mol结构中含有4NA 个Si一O键,故A错误;B、铝离子水解,溶液中的离子总数为大于NA,故B错误; C、标准状况下,水是固液混合物,22.4 L H2O质量约为22400g,远大于1mol,故所含原子个数大于3NA,故C正确;D、含4 mol HCl的浓盐酸,反应进行到一定程度变成稀盐酸就不再反应了,故D错误。
故答案选C
【思路点拨】本题考查了阿伏伽德罗常数的分析应用,注意明确标况下气体摩尔体积的使用
条件,C为易错点,注意认真分析题中信息,二氧化硅的结构分析判断是解题关键,题目难
度中等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
吸食“摇头丸”会严重破坏中枢神经,其化学式为C9H13N,请回答:
2 mol“摇头丸”所含的碳原子的物质的量为______mol,氢原子的物质的量为______mol,氮原子的物质的量为______mol,氮原子的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)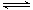 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g)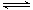 CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)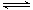 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率
为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g)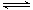 CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如上图所示。b电极是 极,写出b电极上发生的电极反应式 。
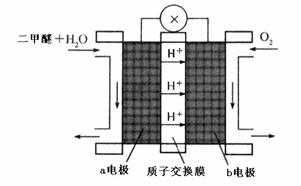
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了测定三聚氰胺的分子式,设计了如下实验:
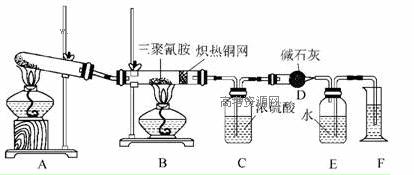
查阅资料,三聚氰胺的相对分子质量为126,在常温下为晶体,由碳、氢、氮三种元素组成,加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g三聚氰胺晶体按图示实验装置进行三聚氰胺与氧气的反应(假设三聚氰胺完全转化成产物),并通过测定生成物的量计算三聚氰胺的分子组成。
(1)写出A装置中发生反应的化学方程式_______________________________________。
(2)C装置能不能与D装置互换?__________(填“能”或“不能”)。理由是__________________________。
(3)当B装置中反应完全发生后,读取F中水的体积的实验操作顺序为__________(填序号)。
①读数 ②冷却至室温 ③调平E、F装置中的液面
(4)测定数据如下:
| 装置 | C | D |
| 实验前 | 101.0 g | 56.0 g |
| 实验后 | 106.4 g | 69.2 g |
经测定,E中收集的气体折合成标准状况下的体积为6.72 L。
①利用上述实验数据,计算三聚氰胺的分子式为__________。
②若B装置中没有铜网,对测定结果的影响是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1说明2 mol H2(g)和1 mol O2(g)的能量总和小于2 mol H2O(g)的能量
B.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,
则含20 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1
2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数
Ka1=4.2×10-7mol·L-1 、 Ka2=5.6×10-11mol·L-1
(1)常温下,物质的量浓度相同的下列四种溶液: a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液。其PH由大到小的顺序是: (填序号)。
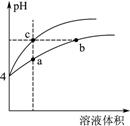 (2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
a.c(H+) b.c(OH-)
c.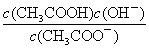 d.
d.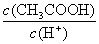
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | 氢氧化钠溶液的浓度(mol·L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23. 88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
⑷在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,
已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25ºC,若12体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,
该碱的pH与强酸的pH之间该满足的关系是_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com