
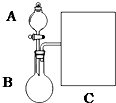
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
分析 (1)①依据物质的状态确定存放的位置;
②生石灰与水反应生成碱,结合一水合氨电离平衡移动的影响因素分析;
③氨气密度小于空气密度,用向下排气法收集;考虑氨气污染空气,应进行吸收处理;
(2)①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物;
分别做两组银镜反应的实验,一组加少量碱,一组不加在相同的水浴条件下反应根据反应速率快慢解答;
③根据酸碱中和反应:H++OH-=H20,H+与OH-量的关系求算.
解答 解:(1)①生石灰是固体应盛放在烧瓶中,
故答案为:B;
②一水合氨存在电离平衡NH3+H2O?NH4++OH-,生石灰与水反应生成碱使溶液中的氢氧根离子浓度增大,根据平衡移动的规律,增大氢氧根离子浓度,平衡向逆方向进行,有利于氨气的逸出,
故答案为:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出;
③氨气密度小于空气密度,用向下排气法收集;考虑氨气污染空气,可用蘸有硫酸的棉花团进行吸收处理,
故答案为: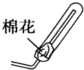 ;
;
(2)①银镜反应的关键有两个:1银氨溶液的配置,该反应是在碱性环境下发生;2反应的条件:水浴加热.猜想:因素一:银氨溶液的pH大小,所以因素二:水浴加热的条件,
故答案为:反应(水浴)的温度;
②AgNO3溶液与氨水反应生成氢氧化银沉淀,氢氧化银再和氨水发生络合反应生成可溶性络合物,预期看到的现象为:先产生白色沉淀,然后沉淀逐渐溶解,
故答案为:先出现白色沉淀后沉淀溶解;
要验证因素一:银氨溶液的pH大小对反应的影响,应该定住因素二,也就是在相同的热水浴中做PH值不同条件下的两组银镜反应,通过反应速率快慢验证结论,
故答案为:往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热,若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢;
③根据方程式H++OH-=H20,达到终点时存才n(H+)=n(OH-),0.0050mol/L×2×20.04mL=C(OH-)×20.00mL,解得:C(OH-)=0.01002 mol/L;
故答案为:0.01002 mol/L.
点评 本题考查了氨气的简易制备和性质,银镜反应的实验,酸碱滴定测碱的物质的量浓度,题目综合性强,难度中等,注意银镜反应中银氨溶液的配置和银镜反应的条件.


科目:高中化学 来源: 题型:解答题
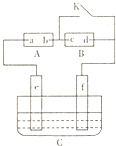 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;其反应类型是消去反应.
;其反应类型是消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH5的电子式为: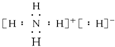 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: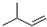 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
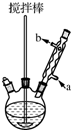 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com