
| A. | 甲中由水电离出来的H+的物质的量浓度是乙$\frac{1}{10}$的倍 | |
| B. | 甲、乙两杯溶液物质的量浓度之间的关系为:c(甲)=10c(乙) | |
| C. | 中和含有等物质的量NaOH的溶液,需甲、乙两杯酸的体积(V)之间关系为:10V(甲)>V(乙) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |
分析 A.酸溶液中氢氧根离子只能由水电离,所以水电离出的c(H+)等于溶液中c(OH-);
B.溶液越稀,醋酸的电离程度越大,据此判断酸的浓度大小;
C.中和等物质的量的NaOH溶液,弱酸的浓度越大,消耗酸的体积越小;
D.根据c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$进行解答;
解答 解:A.pH=-lgc(H+),c(H+)=10-pH,所以c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(H+)甲=10c(H+)乙,酸溶液中水电离出的c(H+)等于溶液中c(OH-),c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,所以氢氧根离子浓度:10c(OH-)甲=c(OH-)乙,则水电离出的氢离子浓度10c(H+)甲=c(H+)乙,故A正确;
B.弱酸酸的浓度越大,酸的电离程度越小,醋酸为弱酸,c(H+)甲=10-a,c(H+)乙=10-(a+1),所以c(甲)>10c(乙),故B错误;
C.弱酸的浓度越大,酸的电离程度越小,醋酸与等量NaOH反应,醋酸的浓度越大则消耗酸的体积越小,c(甲)>10c(乙),所以消耗醋酸的体积,10V(甲)<V(乙),故C错误;
D.c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,所以氢氧根离子浓度:10c(OH-)甲=c(OH-)乙,故D错误;
故选:A.
点评 本题考查弱电解质乙酸的电离,注意弱电解质的电离程度和浓度的关系是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
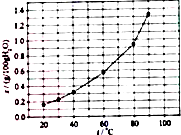
| A. | 溴酸银的溶解是吸热过程 | |
| B. | 温度升高时溴酸银溶解速度加快 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-3 | |
| D. | 若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
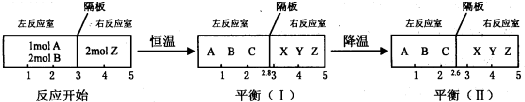
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{135}{53}$I是碘的一种同素异形体 | |
| B. | $\stackrel{135}{53}$I是一种新发现的元素 | |
| C. | $\stackrel{135}{53}$I位于元素周期表中第四周期ⅦA族 | |
| D. | $\stackrel{135}{53}$I核内的中子数与核外电子数之差为29 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
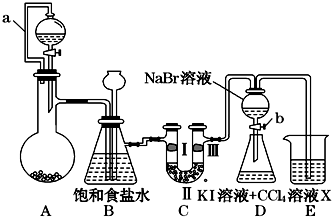 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2═2 I2+2H2O | |
| D. | 服用阿司匹林过量出现水杨酸(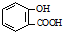 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: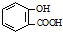 +2 HCO3-→ +2 HCO3-→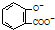 +2 CO2↑+2 H2O +2 CO2↑+2 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com