
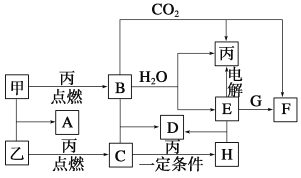
����Ŀ���ס��ҡ���Ϊ�������ʡ�A��B��C��D��E��F��G��H��Ϊ��ѧ��ѧ�г����Ļ��������B��G����ɫ��Ӧ��Ϊ��ɫ��C��ʹƷ����Һ��ɫ����һ�������£��������ת����ϵ��ͼ��ʾ��
��ش��������⣺
��1���û�ѧʽ��ʾ����Ϊ__________��HΪ__________��
��2��A�ĵ���ʽΪ___________________��
��3�����E��ˮ��Һʱ��E��������_____________________
��4��д��B��C�D��D�Ļ�ѧ����ʽ__________________________
д��E��G�D��F�����ӷ���ʽ_______________________________
���𰸡�
��1��O2 SO3
��2�� ![]()
��3����ǿ��Һ�ĵ�������
��4��Na2O2��SO2===Na2SO4��2OH����CO2=== CO32-��H2O
��������
����������ס��ҡ���Ϊ�������ʣ�A��B��C��D��E��F��G��H��Ϊ��ѧ��ѧ�г����Ļ��������B��G����ɫ��Ӧ��Ϊ��ɫ��������NaԪ�أ�B���������̼��ˮ��Ӧ���ɵ��ʱ�����BΪNa2O2����ΪO2��AΪNa��EΪNaOH��FΪNa2CO3��G����ɫ��ӦΪ��ɫ�����������Ʒ�Ӧ�õ�̼���ƣ��ж�GΪNaHCO3��C��ʹƷ����Һ��ɫ���ɵ�������������Ӧ�õ�������ΪS��AΪNa2S��CΪSO2��HΪSO3��DΪNa2SO4��
��1��������������֪����ΪO2��HΪSO3���ʴ�Ϊ��O2��SO3��
��2��AΪNa2S������ʽΪ ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��3�����NaOH��ˮ��Һʱ��ʵ���ǵ��ˮ��NaOH�������ǣ���ǿ��Һ�����������ʴ�Ϊ����ǿ��Һ����������
��4��B+C��D�ǹ����������������Ӧ���������ƣ���Ӧ��ѧ����ʽΪ��Na2O2+SO2=Na2SO4��B��G���������ƺ�̼��������Һ�ķ�Ӧ����Ӧ�����ӷ���ʽΪ��HCO3-+OH-=CO32-+H2O���ʴ�Ϊ��Na2O2+SO2=Na2SO4��HCO3-+OH-=CO32-+H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��HSO3->I-��������IO3->I2���ں�3 mol NaHSO3����Һ����μ���NaIO3��Һ������NaIO3�����ʵ�����������I2�����ʵ����Ĺ�ϵ������ͼ��������I2+I- ![]() I3-������˵������ȷ����
I3-������˵������ȷ����

A��a��ʱ����NaHSO3�����ʵ���Ϊ1��2mol���õ�����������ΪSO42-
B��b��c�εķ�Ӧ�����������ӷ���ʽ��ʾ��IO3-+5I-+6H+=3I2+3H2O
C���μӹ�����ˮ�ĵ���ƽ��һֱ�����ƶ���
D����c������û��Һ�з������IJ���Ϊ�������Ȼ�̼��ȡ��Һ��Ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��������CO��SO2�ֱ�װ��ͬ��ͬ���������������������֮�� ��������ԭ��֮�� ���ܶ�֮�� ��ѹǿ֮�� ��
(2)����״����224L��HCl����1000gˮ����ܶ�Ϊ1.23g/cm3��Һ��������Һ�����ʵ���Ũ��Ϊ_______ molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ���л���ѧ�������ӱ������еõ�һ����A��C10H16������A��ط�Ӧ���£�
��1��H�ķ���ʽΪ ��
��2��B���������ŵ�����Ϊ ��
��3����������COOCH3���ŵ�C��ͬ���칹�干�� �֣������������칹�������к˴Ź������׳���2�����շ���칹��ṹ��ʽΪ ��
��4��D��E�ķ�Ӧ����Ϊ ��
��5��GΪ����Ԫ���Ļ����д����ṹ��ʽ�� ��
��6��д��E��F�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��Ϊ�л������A�Ƿ���ʽΪC5H10O��ֱ�������B��NaHCO3��Һ��ȫ��Ӧ�������ʵ���֮��Ϊ1��2������֮��Ĺ�ϵ��ͼ��ʾ����ʾ��RCH=CHR�������Ը��������Һ�з�Ӧ����RCOOH��R��COOH������R��R��Ϊ���������������������ǣ� ��

A��B�Ľṹ��ʽΪHOOC��CH2��COOH
B��C���Ҵ�������������Ӧ
C��A�Ľṹ��ʽ��CH3��CH��OH����CH=CH��CH3
D��E�ķ���ʽΪC3H2O4Na2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���A��B��C��D��E�����л�����й���Ϣ��

���ݱ�����Ϣ�ش��������⣺
��1��A����ˮ��Ӧ������������ƽ��� ��д����һ�������£�A���ɸ߷��ӻ�����Ļ�ѧ����ʽ�� ��
��2��A�����������ӳɷ�Ӧ�����ɷ���F����F�ڷ�����ɺͽṹ�����Ƶ��л�����һ����(�׳���ͬϵ����)�����Ǿ�����ͨʽ ����n�� ʱ�������л��↑ʼ����ͬ���칹�塣
��3��B��������� (�����)��
����ɫ��ζҺ�� ���ж� ��������ˮ ���ܶȱ�ˮ�� ���κ������²���������Ӧ ����ʹ���Ը��������Һ����ˮ����ɫд����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
��4��д����C��������D�Ļ�ѧ����ʽ�� ��
��5��C��E��Ӧ��������Է�������Ϊ100�������÷�Ӧ����Ϊ ���仯ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��AgNO3�������Ժ����ȶ���,ij��ѧ��ȤС�����������ʵ�顣
��.AgNO3��������
����������˿����AgNO3��Һ��,һ��ʱ�����˿ȡ����Ϊ������Һ��Fe����������,����Һ�е�Ag+������,����������ʵ�顣��ѡ�õ��Լ�:KSCN��Һ��K3[Fe(CN)6]��Һ����ˮ��
��1��������±�:
���� | ���� | ���� |
ȡ��������Ag+�����Һ���Թ���,����KSCN��Һ,�� | �� | ����Fe3+ |
ȡ��������Ag+�����Һ���Թ���,������ ,�� | �� | ����Fe2+ |
��ʵ����ۡ�Fe����������ΪFe2+��Fe3+
��.AgNO3�����ȶ���
����ͼ��ʾ��ʵ��װ��A����AgNO3����,��������ɫ����,��װ��D���ռ�����ɫ���塣����Ӧ������,�Թ��в�������Ϊ��ɫ��

��2��װ��B�������� ��
��3����С�����۲���֤����ɫ����ΪO2,����֤������ ��
��4�����������ϡ�Ag2O�ͷ�ĩ״������Ϊ��ɫ;Ag2O�����ڰ�ˮ��
��������롿�Թ��в����ĺ�ɫ���������: ��.Ag; ��.Ag2O; ��.Ag��Ag2O��
��ʵ����֤����С��Ϊ��֤��������,�ֱ�ȡ������ɫ��������Թ���,����������ʵ�顣
ʵ���� | ���� | ���� |
a | ����������ˮ,�� | ��ɫ���岻�ܽ� |
b | ��������ϡ����,�� | ��ɫ�����ܽ�,����������� |
��ʵ�����ۡ���������ʵ��,����ȷ���������ɷֵ�ʵ���� (��ʵ����)��
��ʵ����ۡ���������ʵ����,д����С��ó�AgNO3�����ȷֽ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������أ� ����˵����ȷ���ǣ� ��
A����±��������������
B���Ӻ�ˮ����ȡ���ʶ�Ҫͨ����ѧ��Ӧ����ʵ��
C��ú����������Һ���������仯��ת��Ϊ���ȼ��
D������������ľ�����ά�����ڹ���ͨ�ŵĹ��ά�����������ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijδ֪��Һ���Ƿ���SO![]() �����в������������( )
����������������( )
A������HNO3�ữ��Ba(NO3)2��Һ
B�������������ữ���ټ�BaCl2��Һ
C���ȼ�HNO3�ữ���ټ�Ba(NO3)2��Һ
D�����������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com