
 SO2Cl2(l) ��H����97.3kJ/mol
SO2Cl2(l) ��H����97.3kJ/mol| A����С������� | B��ʹ�ô��� | C������SO2Ũ�� | D�������¶� |
 SO2Cl2(l)
SO2Cl2(l) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)  2Ag+(aq)+SO42-( aq)
2Ag+(aq)+SO42-( aq) 


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)���ﵽƽ��ʱ�����c(C)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(C)Ϊ0.3 mol��L-1���������ж���ȷ���ǣ� ��
pC(g)���ﵽƽ��ʱ�����c(C)Ϊ0.5 mol��L-1�����¶Ȳ���������£��������������һ�������ﵽƽ��ʱ�����c(C)Ϊ0.3 mol��L-1���������ж���ȷ���ǣ� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3 ������һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ���
2SO3 ������һ������Ӧ���ȵĿ��淴Ӧ�������й�˵���д�����ǣ���| A��ʹ�ô�����Ϊ�˼ӿ췴Ӧ���ʣ��������Ч�� |
| B�����������£�SO2������100��ת��ΪSO3�� |
| C���ﵽƽ��״̬ʱ��SO2Ũ����SO3Ũ����� |
| D���ﵽƽ��״̬ʱ��SO2������������SO2������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2C(g)��2D��g������Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol����
2C(g)��2D��g������Ӧ���е�10sĩ�����A�����ʵ���Ϊ1.8mol��B�����ʵ���Ϊ0.6mol��C�����ʵ���Ϊ0.8mol���� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol��L-1,c(B)="0.200" mol��L-1, c(C)="0" mol��L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc(A)="0.100" mol��L-1,c(B)="0.200" mol��L-1, c(C)="0" mol��L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����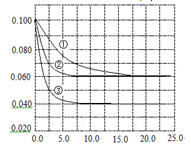
 C����H��0
C����H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ϳɰ���������ý�ӿ췴Ӧ���� |
| B����ѹ�ȳ�ѹ�����ںϳ�SO3�ķ�Ӧ |
| C����H2��I2(g)��HI(g)������ɵ�ƽ����ϵ��ѹ����ɫ���� |
| D���ռ����������ű���ʳ��ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 PCl3(g)+Cl2(g)����H1>0 K1=10
PCl3(g)+Cl2(g)����H1>0 K1=10 COCl2(g)����H1<0 K2= 5��103
COCl2(g)����H1<0 K2= 5��103  COCl2(g) + PCl3(g) K3
COCl2(g) + PCl3(g) K3| A�����ͷ�Ӧ�١�����ϵ��Cl2Ũ�� | B����Ӧ�١���ѡ��ͬ�Ĵ��� |
| C����Ӧ�١���Ӧ��ͬʱ�����¶� | D�����ͷ�Ӧ�١���Ӧ�ڵ���ϵѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת������
2AB3������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ����ƽ��ʱA��ת������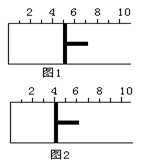
| A��20% | B��40% | C��60% | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 1/2N2��g����CO2��g����H="-373.2" kJ/mol���ﵽƽ���Ϊ����߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ�Ĵ�ʩ��ȷ���ǣ� ��
1/2N2��g����CO2��g����H="-373.2" kJ/mol���ﵽƽ���Ϊ����߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ�Ĵ�ʩ��ȷ���ǣ� ��| A���Ӵ���ͬʱ�����¶� | B���Ӵ���ͬʱ����ѹǿ |
| C�������¶�ͬʱͨ��N2 | D�������¶�ͬʱ����ѹǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com