
【题目】在2L的恒温恒压密闭容器中投入2molSO3发生反应:2SO3(s) ![]() 2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
A.用SO3表示的反应速率为0.2mol·L-1·min-1
B.若O2的体积分数不变,证明该可逆反应已达平衡
C.在2min时,v正(SO2)=2v逆(O2)
D.平衡后,再投入2 mol SO3,则正反应速度加快,逆反应速率不变
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:

(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池体积小巧、燃料使用便利、洁净环保、理论能量比高,用甲烷燃料电池为下图电解装置供电,工作一段时间后,A池中左右试管收集到的气体体积比为2:1,则:
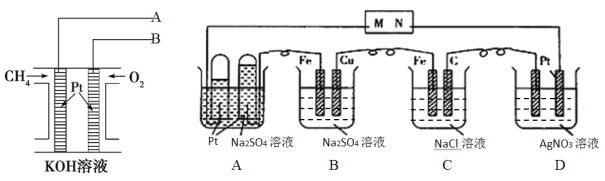
(1)电解一段时间后,甲烷燃料电池中溶液的pH_________。(填“增大、减小或不变”)
(2)甲烷燃料电池中导线A与电解池中的_________(填M或N)导线连接
(3)B池中一段时间后实验现象______________________________________________。
(4)相同条件下,电解质足量的A、B、C、D池中生成气体的总体积由大到小的顺序为_______。
(5)D池电解一段时间后,若要使电解质溶液恢复到电解前的状态,可加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
CH4(g)+2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,CO2的体积分数增加。下列关于该过程的判断错误的是( )
A.该反应的△S<0B.正反应速率增大,逆反应速率也增大且增加的倍数更大
C.化学平衡常数K增大D.CH4的产率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
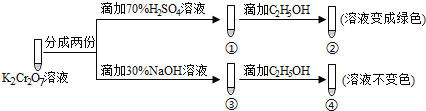
结合实验,下列说法错误的是( )
A.①中溶液橙色加深,③中溶液变黄B.对比②和④可知K2Cr2O7酸性溶液氧化性强
C.②中C2H5OH使Cr2O72-被氧化D.若向④中加入70%H2SO4溶液至过量,溶液可变为绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途.
![]() 一
一![]() 如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和![]() 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:
![]()
![]() 中所含的化学键有 ______ .
中所含的化学键有 ______ .
(2)氯化亚铜![]() 的制备过程是:向
的制备过程是:向![]() 溶液中通入一定量
溶液中通入一定量![]() ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
![]() 二
二![]() 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知![]() 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______ ![]() 填元素符号
填元素符号![]() .
.
(2)请在上图中把![]() 结构中的化学键用短线“--”表示出来.______
结构中的化学键用短线“--”表示出来.______
(3)往浓![]() 溶液中加入过量较浓的
溶液中加入过量较浓的![]() 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的![]() 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色![]() 晶体.实验中所加
晶体.实验中所加![]() 的作用是 ______ .
的作用是 ______ .
(4)![]() 晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是![]() 杂化的原子是 ______ .
杂化的原子是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价代数和为零;Z的非金属性在同周期元素中最强。下列说法正确的是( )

A.对应简单离子半径:W<X
B.对应最简单气态氢化物的稳定性:Y>Z
C.化合物XZW既含离子键,又含共价键
D.Y的氧化物均能与Z的氢化物和X的最高价氧化物的水化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com