
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(第1空1分,其余空2分)
(1) 第三周期ⅦA族;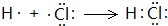 ;185
;185
(2)Cl2+S2-=2Cl-+S↓或Cl2+H2S=2H++2Cl-+S↓ ; BC
(3)HS-+OH-=S2-+H2O
解析试题分析:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A有多种核素,其中一种没有中子,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;E元素原子的最外层电子数是其次外层电子数的3/4,最外层电子数为6,则E为S元素;D与A同主族,且与E同周期,则D为Na;A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O元素;F原子序数最大,则F为Cl元素;(1)F为Cl元素,在元素周期表中的位置是:第三周期ⅦA族;H与Cl两种元素组成的化合物为HCl,用电子式表示HCl的形成过程为: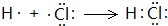 ,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
,反应方程式为H2+Cl2=2HCl,反应生成2mol产物时释放的能量=2×432kJ-(436kJ+243kJ)=185kJ;(2)用离子方程式表示S、Cl两种元素的非金属性强弱为:Cl2+S2-=S↓+2Cl-,可以根据单质与氢气反应的难易程度及最高价氧化物对应水化物的酸性强弱比较非金属性强弱,单质沸点属于物理性质,不能比较非金属性强弱,故A错误,BC正确;(3)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O。
考点:考查元素位置、结构与性质的关系,以及元素金属性非金属性强弱比较、化学键、电子式等相关知识。


科目:高中化学 来源: 题型:填空题
(10分)(1)写出氯原子的原子结构示意图
(2)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(3)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(4)请写出下列物质的电子式。H2O CO2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。
试回答下列问题:
(1)元素M在第________周期第________族。
(2)C的10电子氢化物的电子________,D的简单氢化物的空间结构为________________。
(3)试写出一种由上述3种元素组成的不含有金属元素的离子化台物____________(填化学式)。
(4)上述元素中非金属性最强的元素是_____________(填元素符号),元素最高价氧化物对应水化物酸性最强的物质是_____________(填化学式)。
(5)写出G与I的最高价氧化物对应水化物反应的离子方程式:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。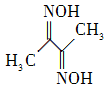
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。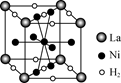
(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| | | | |||||||||||||||
| | | | | h | | | | | |||||||||
| a | c | f | | i | | | m | ||||||||||
| | | | e | | | | | | | | | | g | | k | | |
| | d | | | | | | | | | | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学选修——3:物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。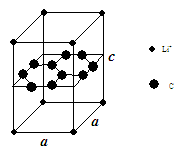
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com