
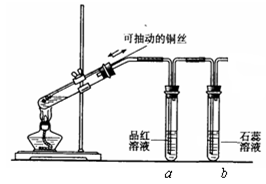
 CuSO4 + SO2↑+ 2H2O (2分)
CuSO4 + SO2↑+ 2H2O (2分)

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞 |
查看答案和解析>>
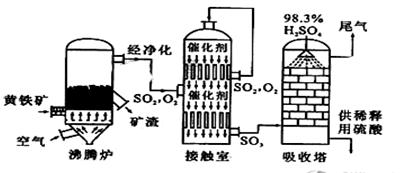
科目:高中化学 来源:不详 题型:实验题
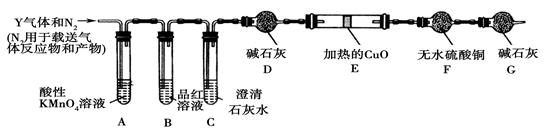
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2+H2O=H2SO3 | B.SO2+2NaOH=Na2SO3+H2O |
| C.2SO2+O2=2SO3 | D.SO2+CaO=CaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸可以使某些气体干燥是利用了它的脱水性 |
| B.王水是浓盐酸和浓硝酸按体积比1∶3配成的混合物,可以溶解Au、Pt |
| C.氨气被催化氧化成一氧化氮是氮的固定 |
| D.新制备的氯水中存在三种分子、四种离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.通过品红溶液 | B.通过澄清石灰水 |
| C.先通过高锰酸钾溶液,再通过澄清石灰水 | D.先通过澄清石灰水, 再通过高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定条件下弱酸可以制强酸 | B.饱和溶液中H2S比CuS提供的S2-浓度大 |
| C.CuS不溶于硫酸 | D.反应FeSO4+H2S ® FeS¯+H2SO4也能发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸与木炭共热 | B.胆矾中加浓硫酸 |
| C.乙酸乙酯与稀硫酸共热 | D.浓硫酸滴到蔗糖中制“黑面包” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com