
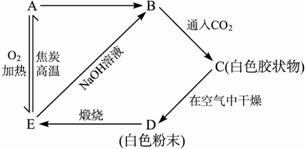
 ?
?
A是___________,B是__________,C是___________,D是__________,E是___________。??
科目:高中化学 来源: 题型:阅读理解
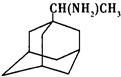 中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.
中新网2009年5月21日电:据法新社报道,世界卫生组织宣布全球感染甲型H1N1流感患者已升至11034人.根据所有的资料显示,“达菲”是国际上公认的治疗流感的药物之一.广东省中医院呼吸内科主任林琳教授解释,目前我们常用的抗病毒药有两大类,一个是金刚烷胺类药物,另一个是神经氨酸酶抑制剂类药物.据现在研究的情况,甲型H1N1流感病毒对金刚烷胺类药物不敏感,而对神经氨酸酶抑制剂类药物如达菲还是敏感的.
 )
)

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)= 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
|
试剂 用量 (mL) | 0.20 mol·L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3+ SO2= Na2SO3 + CO2;2Na2S + 3SO2= 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011年云南省高二下学期期末考试化学试卷 题型:实验题
(13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)=  。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
|
实 验 编 号 |
① |
② |
③ |
④ |
⑤ |
|
|
试剂 用量 (mL) |
0.20 mol·L-1 (NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
|
0.20 mol·L-1 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010 mol·L-1 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2% 淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20 mol·L-1KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
|
0.20 mol·L-1(NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20 ℃时,反应时间Δt(s) |
32 |
67 |
130 |
66 |
135 |
|
|
为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
![]() (NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
(NH4)2S2O8和KI反应的离子方程式为:S2O82- + 2I-= 2SO42- + I2 (1)
平均反应速率的计算式为v(S2O82-)= 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 = S4O62-+ 2I- (2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
| 试剂 用量 (mL) | 0.20 mol·L-1 (NH4)2S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol·L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的v(S2O82-)= mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)
。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
|
|
|
|

(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
① ;
② 。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)
A.下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
|
| |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表
的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)①③两元素形成的最简单的化合物与 (写微粒符号)互为等电子体。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___ 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力
为 。
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分 别如右图所示。 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
B.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
(1)写出反应①的平衡常数表达式K=__________________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________。以CO2为原料合成乙醇的优点是 (写出一条即可)。
 |
根据表中数据分析:
①温度升高,K值______(填“增大”、“减小”或“不变”)。
②提高氢碳比[ n(H2)/n(CO2)],对生成乙醇 (填“有利”、“不利”)。
 (4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
(4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com