
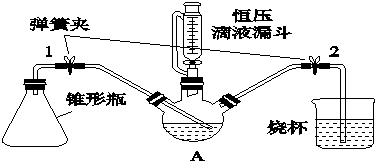
分析 (1)根据仪器的特征和用途分析;
(2)根据装置内外的压强差会产生气泡或在导管中形成液柱判断装置是否密封;
(3)恒压滴液漏斗代替分液漏斗可以平衡内外压强,使盐酸顺利滴下;
(4)Cr2+极易被氧化成Cr3+,所以溶液中不能有氧存在;
(5)装置A中是用锌还原K2Cr2O7生成亚铬离子,从质量守恒、电荷守恒和电子守恒的角度配平方程式;Cr2+在溶液中为蓝色,据此确定反应完成的标志;
(6)洗涤产品最好选用有机溶剂易挥发易干燥,且溶解度小;
(7)根据铬守恒计算出1.47g K2Cr2O7 粉末的理论产品质量,结合产率=$\frac{实际质量}{理论质量}$×100%计算;
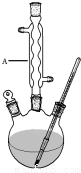
解答 解:(1)上图装置中,A仪器有三个口,可以同时加入多种反应物,且连接冷凝管,为三颈烧瓶,
故答案为:三颈烧瓶;
(2)根据装置内外的压强差会产生气泡或在导管中形成液柱判断装置是否密封,实验操作为将装置连接好,关闭弹簧夹1.2,往装置A中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好.反之,则气密性不好,
故答案为:将装置连接好,关闭弹簧夹1.2,往装置A中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好.反之,则气密性不好;
(3)和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,更好地控制溶液滴入的速率,同时可以保证恒压滴液漏斗中的液体顺利滴下,
故答案为:平衡压强,使液体顺利滴下;
(4)Cr2+极易被氧化成Cr3+,所以溶液中不能有氧存在,所以本实验中所有配制溶液的水需煮沸,去除水中的溶解氧,防止Cr2+被氧化,
故答案为:去除水中的溶解氧,防止Cr2+被氧化;
(5)锌和重铬酸根离子反应,反应中Cr元素化合价由+6价降低到+3价,Zn元素化合价由0价升高到+2价,则最小公倍数为6,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3Zn+14H+?2Cr3++3Zn2++7H2O,反应完成的标志是溶液变为蓝色,
故答案为:Cr2O72-+3Zn+14H+?2Cr3++3Zn2++7H2O;溶液变为蓝色;
(6)洗涤产品时,最好选用无水乙醇,减小产品的损耗,同时因乙醇易挥发,易于干燥,
故答案为:b;
(7)1.47g K2Cr2O7 粉末的物质的量为 $\frac{1.49g}{294g/mol}$=0.005mol,根据铬守恒,理论生成无水醋酸亚铬(Cr(CH3COO)2)产品质量为0.005mol×2×170g/mol=1.7g,最后获得的无水醋酸亚铬产品质量为 1.38g,则产品的产率为 $\frac{1.38g}{1.7g}$×100%≈81.18%,
故答案为:81.18.
点评 本题主要考查醋酸亚铬的制取、氧化还原、滴定计算等知识点,题目难度中等,为高考的高频题,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | 减少使用化石燃料 | |
| B. | 大力发展火力发电 | |
| C. | 改变能源结构,开发使用清洁能源 | |
| D. | 将煤气化或液化,以提高其综合利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
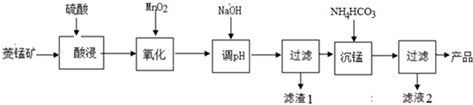
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(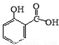 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应 | B. | 氮的氧化物排放 | C. | 白色污染 | D. | 对臭氧层的破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| B. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 | |
| C. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| D. | 研发光电转换材料,充分利用太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d | B. | 2d | C. | 3d | D. | 4d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com