
| A. | 不锈钢属于一种铁合金 | |
| B. | 纤维素是蚕丝的主要成分 | |
| C. | 水泥是生活中常见的硅酸盐材料 | |
| D. | 二氧化硅是制造光导纤维的主要原料 |
分析 A.不锈钢是钢的一种,是铁的合金;
B.蚕丝是天然纤维,主要成分是蛋白质;
C.三大传统硅酸盐产品是玻璃、陶瓷、水泥;
D.光导纤维是以纯净的二氧化硅晶体为原料制造的.
解答 解:A.不锈钢是铁合金,还含有抗腐蚀性很强的铬和镍,故A正确;
B.蚕丝属于天然纤维,主要成分是蛋白质,故B错误;
C.玻璃、陶瓷、水泥成分中含有硅酸盐属于硅酸盐材料,是生活中常见的硅酸盐材料,故C正确;
D.光导纤维传递光信号的原理是光的全反射,SiO2具有良好的光学效果材料,是制造光导纤维的主要原料,故D正确.
故选B.
点评 本题主要考查了合金、无机非金属材料、蚕丝的成分等,题目难度不大,注意制光导纤维的原料二氧化硅、蚕丝的成分是高频考点.


科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应可鉴别NaCl和KCl | |
| B. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 在食品包装袋中放入硅胶防止食品变质,是利用硅胶的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 | |
| B. | 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 | |
| C. | VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2NA | |
| D. | CaC03在饱和Na2C03溶液中的KSP比在纯水中的KSP小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡绿色出行 | B. | 提倡使用无磷洗涤剂 | ||
| C. | 提倡使用一次性塑料袋 | D. | 提倡垃圾分类和回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
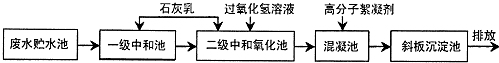
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol•L)-1 | 0.16 | 0.94 | 0.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后(溶质都有剩余),回答下列问题(不考虑溶液体积变化)
下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后(溶质都有剩余),回答下列问题(不考虑溶液体积变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 000 | 850 | 690 | 625 | 400 |
| A. | 反应I2(aq)+I-(aq)?═?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,向溶液中加入少量KI固体,平衡常数K小于690 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
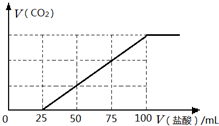 钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
钠及其化合物在生产和生活中有广泛的应用.完成下列计算:| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com