
X、Y、Z均由短周期元素组成的中学常见物质,存在如下转化关系:
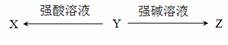 ,下列说法错误的是
,下列说法错误的是
A.Y可能是氧化物
B.Y可能是盐类
C.若X、Z是同一物质,则可能是乙醇
D.Y→X、Y→Z不可能同时为氧化还原反应
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
下列有关实验装置的说法中正确的是
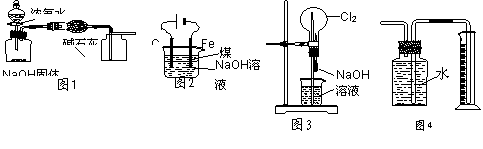 |
A.用图1装置制取干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
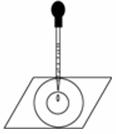
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快
D.氯水中形成次氯酸的反应中还原产物是HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分。
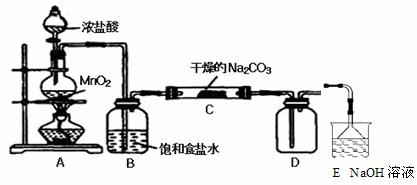
向C装置中通入一定量的氯气后,测得只生成一种气体Cl2O。可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且一定含有NaHCO3,现对C中得到的固体成分进行猜想和验证。
①提出合理猜想:一定含有NaHCO3和 ;可能含有剩余的Na2CO3。
②设计方案,进行成分检验:
请完成实验步骤3、4以及预期现象和结论并将答案填入下表的相应空格内。
限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中。 | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置。 | 若溶液变浑浊,证明固体中含有 。 |
| 步骤3:取甲试管中上层清液少许于另一只试管中,滴加少量 ,充分振荡。 | 若 , 证明固体中含有NaHCO3 。 |
| 步骤4:向乙试管中先加入过量的 , 再滴入少量 溶液。 | 若生成白色沉淀;证明固体中含有______。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子在溶液中能大量共存是
A.K+、CH3COOH、Br-、SiO32- B.K+、Na+、Cl-、CO32-
C.Na+、Al3+、NH3·H2O、MnO4- D.H+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
果汁在生产过程中添加亚硫酸及其盐类,以抑制有害微生物的生长及抗氧化。某化学兴趣小组查阅文献后,用下图所示装置测定某果汁样品中SO2残留量。
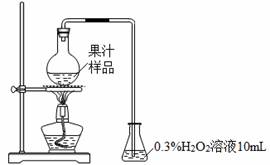
实验步骤:
(ⅰ)在烧瓶中加入50.00 mL果汁样品与3mL浓硫酸的混合液,加热10 min。
(ⅱ)移出锥形瓶,迅速滴入2~3滴酚酞试液,用0.01000 mol·L-1NaOH标准溶液滴定。
回答问题:
(1)实验室配制NaOH标准溶液时,不需要用到的仪器是 。
A.容量瓶 B.胶头滴管 C.烧瓶 D.玻璃棒
(2)将50. 00 mL果汁样品与3mL浓硫酸混合的操作是 。
(3)锥形瓶中发生反应的离子方程式是 。
(4)若步骤(ⅱ)消耗NaOH标准溶液25. 00 mL,则果汁样品中SO2残留量是 g/L。
(5)若改用0.5%的碘水10 mL作吸收液,实验中消耗NaOH标准溶液体积 。
A.V = 25 mL B.25 mL<V<50 mL C.V>50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________________________________________________。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K________1.0(填“大于”、“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________(填“正反 应方向”、“逆反应方向”或“不移动”)。
应方向”、“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某化学反应的平衡常数表达式为K= ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
| t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是 ( )。
A.该反应的化学方程式是CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式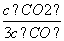 =
=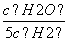 ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)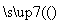 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com