
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
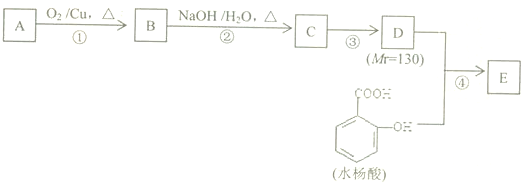
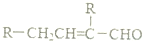
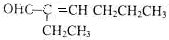 ,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键.
,若要检验C中所含官能团,一次取样检验,按使用的先后顺序写出所用试剂用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展太阳能和风力发电机可缓解电力紧张问题 | |
| B. | 将地沟油回收加工为燃料油,提高资源的利用率 | |
| C. | 推广使用一次性木筷,减少疾病传染 | |
| D. | 推广使用电动汽车、天然气汽车等环保公共交通工具 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 100mL 2mol•L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.20molCaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 200mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.4molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
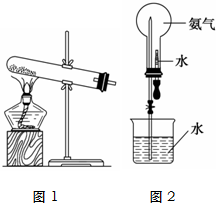 氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:
氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?F-(aq)+H+(aq)△H=+10.4 kJ•mol-1 | |
| B. | NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol | |
| C. | 溶液温度升高后,一定能促进弱电解质的电离 | |
| D. | 将含有0.1molHF与0.1molNaOH的两种物质混合后放出的热量为6.77KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com