
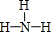 ;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物R2H4是一种火箭燃料的成分,其电子式是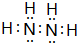 .
.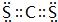 .
. 分析 Q、R、X、Y、Z为前18号元素中的五种,R元素单质中含有叁键,为双原子分子,则R为N元素;Q的低价氧化物与R单质分子(N2)的电子总数相等,则Q为C元素,低价氧化物为CO;X与Q同族,则X为Si;Y和Z的离子与氩原子的电子层结构相同且Y的原子序数小于Z,则Y为S元素、Z为Cl.
解答 解:Q、R、X、Y、Z为前18号元素中的五种,R元素单质中含有叁键,为双原子分子,则R为N元素;Q的低价氧化物与R单质分子(N2)的电子总数相等,则Q为C元素,低价氧化物为CO;X与Q同族,则X为Si;Y和Z的离子与氩原子的电子层结构相同且Y的原子序数小于Z,则Y为S元素、Z为Cl.
(1)Q为碳元素,最高价氧化物为二氧化碳,属于分子晶体,其固体俗名叫干冰,
故答案为:分子;干冰;
(2)X为Si元素,氢化物分子的化学式是SiH4,它与氮原子形成的化合物可作为一种重要陶瓷材料,其化学式是Si3N4,
故答案为:SiH4;Si3N4;
(3)R的常见氢化物为NH3,结构式是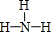 ;它的另一种氢化物N2H4是一种火箭燃料的成分,其电子式是
;它的另一种氢化物N2H4是一种火箭燃料的成分,其电子式是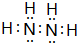 ,
,
故答案为: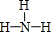 ;
;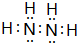 ;
;
(4)碳分别与硫、氯形成的共价化合物的化学式分别是CS2、CCl4,CS2的电子式为: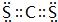 ,
,
故答案为:CS2;CCl4;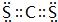 .
.
点评 本题考查结构性质位置关系综合应用,以Y单质分子结构为突破口进行推断,侧重对电子式、元素化合物知识的考查,难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、CO32-、SO42- | B. | NO3- | ||
| C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
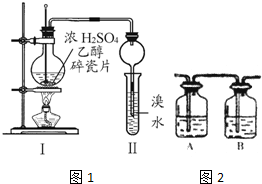 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com