
常温下,Ksp(CaSO4)=9??10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
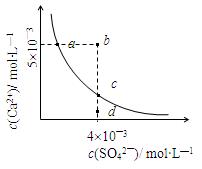
A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42—)对应于曲线上任意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42—)等于3??10-3 mol·L—1
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| c2(OH-) |
| c(SO42-) |
| c2(OH-) |
| c(SO42-) |
| SO | 2- 4 |
| b-0.01 |
| b |
| b-0.01 |
| b |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:选择题
下表中的实验操作能达到实验目的或能得出相应结论的是
选项????????????? 实验操作????????????? 实验目的或结论
A????????????? 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。????????????? 常温下,
Ksp(AgCl)>Ksp(AgI)
B????????????? 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。????????????? 检验KClO3中的氯元素
C????????????? 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。????????????? 说明原溶液中一定含有CO32- 或 SO32-
D????????????? 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。????????????? 除去Mg(OH)2样品中的Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第四次联考理综化学试卷(解析版) 题型:选择题
下表中的实验操作能达到实验目的或能得出相应结论的是
选项????????????? 实验操作????????????? 实验目的或结论
A????????????? 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。????????????? 常温下,
Ksp(AgCl)>Ksp(AgI)
B????????????? 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。????????????? 检验KClO3中的氯元素
C????????????? 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。????????????? 说明原溶液中一定含有CO32- 或 SO32-
D????????????? 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。????????????? 除去Mg(OH)2样品中的Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com