
| A. | 55 mol•g-1 | B. | 55 mol | C. | 55 g•mol-1 | D. | 55g |
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,消耗完氯化铜后电解就会停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
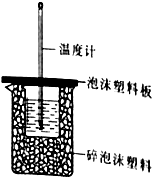 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com