
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 保证盐酸完全被中和 体系内、外温差大,会造成热量损失 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O(l)所放出的能量,与酸碱的用量无关 偏大
【解析】
(1)为了加快酸碱中和反应,减少热量损失,用环形玻璃搅拌棒搅拌;
(2) 为了减少热量损失,在两烧杯间填满碎纸条或泡沫;
(3) 大烧杯上盖硬纸板是为了减少气体对流,使热量损失,若不用则中和热偏小;
(4)加热稍过量的碱,为了使酸完全反应,使中和热更准确;当室温低于10 ℃时进行实验,内外界温差过大,热量损失过多,造成实验数据不准确;
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,计算中和热数据相等,因为中和热为强的稀酸、稀碱反应只生成1mol水时释放的热量,与酸碱用量无关;
(6) 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,氨水为弱电解质,电离时吸热,导致释放的热量减少,计算中和热的数值减少,焓变偏大;


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清代《本草纲目拾遗》中关于“鼻冲水(氨水)”的记载明确指出:“鼻冲水,……贮以玻璃瓶,紧塞其口,勿使泄气,则药方不减……唯以此水瓶口对鼻吸其气,即遍身麻颤出汗而愈,虚弱者忌之。宜外用,勿服。”下列有关“鼻冲水”的推断不正确的是
A. 鼻冲水是弱电解质
B. 鼻冲水滴入酚酞溶液中,溶液变红色
C. 鼻冲水中含有分子和离子的种类为6种
D. 存在平衡:NH3 + H2O ![]() NH3·H2O
NH3·H2O ![]() NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)===2CO(g)+O2(g),该反应的ΔH________(填“>”“<”或“=”)0,ΔS________(填“>”“<”或“=”)0,在低温下,该反应________(填“能”或“不能”)自发进行。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO![]() 2CO2+N2。反应在常温下能够自发进行,则反应的ΔH________(填“>”“<”或“=”)0。
2CO2+N2。反应在常温下能够自发进行,则反应的ΔH________(填“>”“<”或“=”)0。
(3)已知在100 kPa、298 K时石灰石分解反应CaCO3(s)===CaO(s)+CO2(g)的ΔH>0,ΔS>0,则:
①该反应常温下________(填“能”或“不能”)自发进行。
②据本题反应数据分析,温度________(填“能”或“不能”)成为反应方向的决定因素。
(4)已知CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g),ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
CaO(s)+SO2(g)+CO2(g),ΔH=+218 kJ·mol-1,该反应能够自发进行的反应条件是________。
(5)某吸热反应能自发进行,则该反应的ΔS________(填“>”或“<”)0。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)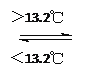 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于锌、铜和稀硫酸组成的原电池(如下图),下列说法错误的是
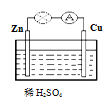
A. 负极电极反应式为Zn-2e- =Zn2+
B. 溶液中SO42-离子向负极移动
C. 电子由Zn片通过稀硫酸流向Cu片
D. 铜片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇之间转化的能量关系如图所示。

(1)甲醇催化脱氢转化为甲醛的反应是_______(填“吸热”或“放热”)反应;
(1)过程Ⅰ与过程Ⅱ的反应热______(填“相同”或“不同”),原因是___________________________________________________________;
(2)写出甲醇催化脱氢转化为甲醛的热化学方程式
__________________________________________________________;
(3) 甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700℃,需向体系中通入空气,通过计算确定进料甲醇与空气的物质的量理论比值为___________________________。(假设:H2(g)+1/2O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气含量为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据SO2通入不同溶液中的实验现象,所得结论错误的是( )
选项 | 溶液 | 现象 | 结论 |
A | H2O2溶液 | 无明显现象 | SO2与H2O2不反应 |
B | H2S溶液 | 产生淡黄色沉淀 | SO2有氧化性 |
C | 酸性KMO4溶液溶液 | 紫色褪去 | SO2有还原性 |
D | 滴有酚酞的NaOH溶液 | 溶液红色褪去 | SO2有酸性氧化物的性质 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com