
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、常温常压下,78gNa2O2固体中所含阴离子数一定为NA |
| C、NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |


科目:高中化学 来源: 题型:
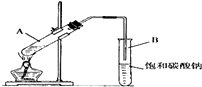 实验室用如图装置制取乙酸乙酯.
实验室用如图装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
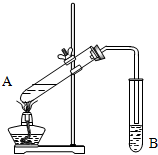 实验室用如图所示装置制取乙酸乙酯.
实验室用如图所示装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ClO2具有强氧化性,可用于自来水的杀菌消毒,优于氯气的高效安全性 |
| B、NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 |
| C、酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 |
| D、Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,10mlpH=12的氢氧化钠溶液中加入10mlpH=2的HA,所得溶液pH≤7 |
| B、25℃时,0.1mol/L与0.01mol/L的氯化铵溶液的pH前者大 |
| C、室温时浓度均为0.1mol/L的NH3?H2O和NH4Cl的混合液,pH为10,则,c(NH4+)+c(H+)<c(NH3?H2O)+c(OH-) |
| D、0.1mol/LNa2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
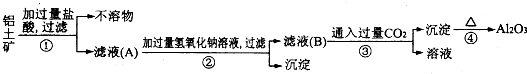
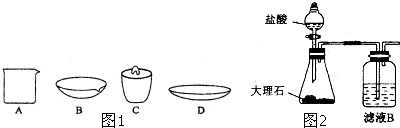
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com