
【题目】某温度时,在一个容积为2L的密闭容器中,A、B、C三种气态物质的物质的重随时间变化曲线如图所示。请回答以下问题:
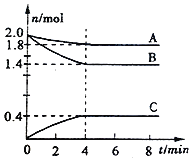
(1)该反应的化学方程式是___________。
(2)反应从开始到平衡时,气体C的平均反应速率是_______ 。
(3)反应达平衡,反应物B的转化率是___;体系的压强是开始时的______倍。
(4)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
【答案】 A(g)+3B(g)![]() 2C(g) 0.05mol/(L·min)30%0.9加快
2C(g) 0.05mol/(L·min)30%0.9加快
【解析】
(1)由图可知,A、B为反应物,C为生成物,A、B、C的物质的量的变化量之比为(2-1.8):(2-1.4):(0.4-0)=1:3:2,4min达到平衡,化学计量数之比等于物质的量的变化量之比;(2)结合v=△c/△t计算,(3)根据转化率的公式计算;(4))升高温度,正逆反应速率均增大;
(1)由图可知,A、B为反应物,C为生成物,A、B、C的物质的量的变化量之比为(2-1.8):(2-1.4):(0.4-0)=1:3:2,4min达到平衡,化学计量数之比等于物质的量的变化量之比,则化学反应为A(g)+3B(g)![]() 2C(g);(2)反应从开始到平衡时,气体C的平均反应速率是
2C(g);(2)反应从开始到平衡时,气体C的平均反应速率是
0.4mol/(2L·4min)=0.05mol/(L·min);(3)反应达平衡,反应物B的转化率是(2.0-1.4)mol/2.0mol×100%=30%;体系的压强是开始时的(1.8+0.4+1.4)/(2.0+2.0)=0.9倍。(4)其他条件不变,升高温度,逆反应速率将加快.。


科目:高中化学 来源: 题型:
【题目】Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。
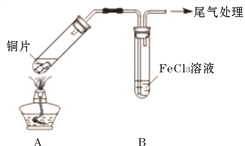
①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________。
(3)已知:B中溶液变红的反应:Fe3++6SO2 ![]() Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的碱性溶液中,能大量共存的离子组是( )
A.Na+、H+、SO42﹣、HCO3﹣
B.Cu2+、K+、SO42﹣、NO3﹣
C.Na+、K+、Cl﹣、NO3﹣
D.Mg2+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照混合物、非电解质、碱、酸式盐的顺序排列正确的是()
A.漂白粉、Cl2、氨水、NaHCO3B.福尔马林、苯、Cu2(OH)2CO3、明矾
C.盐酸、SO2、纯碱、NH4ClD.食醋、C2H5OH、苛性钾、NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
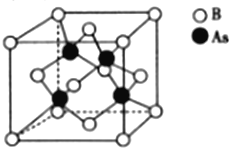
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且常温常压下为气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
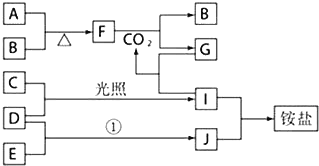
请按下列要求填空:
(1)CO2的电子式____.A的原子结构示意图________,
(2)化合物I的沸点比J的沸点____(填“高”或“低”),理由是 _________。
(3)化合物F中,阳离子与阴离子个数比是____。
(4)写出F和CO2反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
B. 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去
C. 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生
D. 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4molA和2.5molB混合于2L密闭容器中,发生反应:3A(g)+2B(s)![]() xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol·L-1·min-1,错误的是
A. A的平均反应速率为0.15mol·L-1·min-1 B. 平衡时,C的浓度为0.25 mol·L-1
C. B的平均反应速率为0.1mol·L-1·min-1 D. 平衡时,容器内压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. 标准状况下,l mol任何物质的体积均为22.4 L
B. CH4的摩尔质量为16 g
C. 1mol H2O的质量为18 gmol-1
D. 1 mol·L-1NaCl溶液的含义是1 L溶液中含有58.5 g NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com