
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。

完成下列填空:
(1)装置①中除烧杯外另一种玻璃仪器的名称为 。
(2)先关闭K1、打开K2、再打开分液漏斗旋塞,装置②中产生ClO2的化学方程式为 。
(3)当④中出现晶体后,则装置④中的化学反应方程式为 。然后关闭K2、打开K1,装置①的作用 。
将装置④中的溶液进行下列操作得到的晶体为NaClO2的操作步骤为:
①减压,55℃蒸发结晶; ② ;
③用38-60℃的温水洗涤 ④低于60℃干燥,得到成品。
(4)称取1g所得亚氯酸钠样品于烧杯中,加过量酸化碘化钾溶液,充分反应
(ClO2-+ 4I -+4H+ →2H2O+2I2+Cl-),得到25.00ml混合溶液。再用2.0 mol/L Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),共消耗Na2S2O3 20.00ml。
①滴定时指示剂为 ,达到滴定终点的现象为 。
②该样品中NaClO2的质量分数为 。
科目:高中化学 来源: 题型:
下图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子。下列对该过程的相关描述正确的是 ( )
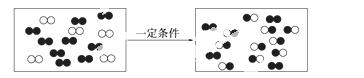
A.有一种物质过量 B.发生的是分解反应
C.发生的是置换反应 D.生成了两种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,试标出反应电子转移方向和数目_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
将浓度都为1mol/L的Na2CO3溶液和稀H2SO4按体积比2:1混合,则下列说法正确的是
A.混合溶液的pH<7
B.混合溶液中:c(SO42-)+c(OH-)< c(HCO3-)+c(H2CO3)+c(CO32-)
C.混合溶液中:c(Na+)+c(H+)<2[c(SO42-)+c(CO32-)]
D.混合溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(SO42-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
B.湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C.用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e-
D.铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将Cl2通入KOH溶液中,反应得到KCl、KClO、KClO3的混合物,经测定c(ClO—): c(ClO3—)=1:3,则此反应中被还原氯元素与被氧化氯元素的质量比为( )
A.21:5 B.11:3 C.3:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化铁样品中含有少量的FeCl2杂质.现要测定其中铁元素的质量分数,按以下步骤进行实验:
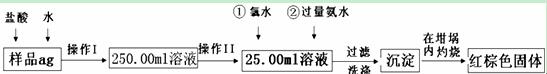
请根据图的流程,回答下列问题:
(1)操作I所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有 ;
(填仪器名称)操作II必须用到的仪器是 。(填字母)
A.50ml烧杯 B.50ml量筒 C.100ml量筒 D.25ml滴定管
⑵再加入氨水的离子方程式为 。
⑶检验沉淀是否洗涤干净的操作是 。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质
量为b2g,若b1—b2=0.3,则接下来还应进行的操作是
。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数
是 。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干
燃烧称量即可,请你评价是否可行? 。(填“可行”或“不可行”)
查看答案和解析>>
科目:高中化学 来源: 题型:
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁(Fe2(SO4)3)、硫酸锌(ZnSO4)和硫酸钾(K2SO4)三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A.3∶2∶2 B 1∶2∶3 C 1∶3∶3 D 3∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com