
下列能够检验出KI中是否含有Br﹣的实验是( )
|
| A. | 加入足量的新制氯水,溶液颜色变深,则含有Br﹣ |
|
| B. | 加入KMnO4酸性溶液,溶液颜色褪去,则含有Br﹣ |
|
| C. | 加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br﹣ |
|
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br﹣ |
| 物质的检验和鉴别的基本方法选择及应用.. | |
| 专题: | 物质检验鉴别题. |
| 分析: | 溴离子、碘离子都具有还原性,且还原性I﹣>Br﹣,加入氧化剂,首先氧化I﹣,检验是应先排除I﹣的干扰,以此解答该题. |
| 解答: | 解:A.新制氯水可以氧化Br﹣,也可以氧化I﹣,而且生成的I2也有颜色,会使溶液变色,故无法判断,故A错误; B.酸性KMnO4可以氧化Br﹣,也可以氧化I﹣,也无法判断,另外KMnO4被消耗后,虽然紫红色褪去了,但是生成的I2或者Br2也有颜色,会使溶液变色,故一般不用KMnO4鉴定卤素离子,故B错误; C.I2不会跟Br﹣反应,这样的操作无法得出任何结论,无论KI中是否含有Br﹣,加入少量碘水,再加入CCL4振荡,有机层永远都会有色,故C错误; D.FeCl3可以和I﹣反应,但不和Br﹣反应,加入足量FeCl3溶液,用CCl4萃取,可以将体系中的I﹣完全除去,氯水中的Cl2可以和Br﹣反应,如果KI中含有Br﹣,这样处理后,无色的水层中应该有Br﹣,加入氯水,溶液会呈橙色,因为生成了Br2,故D正确. 故选D. |
| 点评: | 本题考查离子的检验,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的严密性的评价,结合氧化性、还原性的强弱解答,难度不大. |


科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应式:________________________。
(2)某学生认为,铁电极可能参与反应,并对产物做出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:____________________________________________________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是____________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:________。
Ⅱ.利用如图所示装置做电解50 mL 0.5 mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO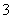 );
);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
①_________________________________________________________;
②_________________________________________________________。
(2)分析实验记录B中浅蓝色固体可能是________(写化学式),试分析生成该物质的原因:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
完全沉淀等物质的量浓度的NaCl.MgCl2.AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为
A.1:1:1 B.3:2:1 C.6:3:2 D.9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
列物质按纯净物、混合物、电解质、非电解质的顺序组合正确的是( )
| 纯净物 | 混合物 | 电解质 | 非电解质 |
| 盐酸 | 水煤气 | 硫酸 | 铜 |
| 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| 纯醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
|
| A. | 蒸馏水、氨水、氢氧化钡、二氧化硫 | B. | 纯盐酸、空气、硫酸、干冰 |
|
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 氧化钙、漂白粉、氧化铝、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向的硫酸中加入100mL18mol/L足量铜片,加热并充分反应.下列有关说法正确的是( )
|
| A. | 充分反应后转移1.8mol电子 | B. | H2SO4只作氧化剂 |
|
| C. | 若不加热应生成H2 | D. | 消耗的铜的质量一定少于57.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣3I2+6OH﹣═IO3﹣+5I﹣+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境下KI与氧气反应的化学方程式: .将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+. .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氢氧化铁胶体的叙述,正确的是
A.往氢氧化铁胶体中逐滴加入稀盐酸先出现沉淀后沉淀溶解
B.在含2 mol的氢氧化铁的胶体中含有氢氧化铁胶粒数为2NA
C. 滤纸可将氢氧化铁胶体中的分散质与分散剂分离
D. 氢氧化铁胶体带正电荷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com