
| A. | 用镊子夹取金属钠固体,切割取用后剩余的钠必须放回原试剂瓶中 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| D. | 在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
分析 A、钠易与空气中氧气和水反应,应保存在煤油中;
B、控制其他量相同,只控制温度不同;
C、Mg与二氧化碳反应;
D、分液时,先从下口放出下层液体,再从上口倒出上层液体.
解答 解:A、做金属钠的性质实验时,剩余的钠放回原试剂瓶,由于钠很活泼,且如果将钠随意丢弃容易引起火灾、爆炸等事故,故A正确;
B、探究温度对反应速率的影响时,控制其他量相同,只控制温度不同,则应将混合物分别在热水、冷水中反应,故B错误;
C、Mg与二氧化碳反应,则不能用泡沫灭火器处理Mg的失火,可用细沙盖灭,故C正确;
D、分液时,避免上下层液体混合,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出,操作合理,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作及实验安全、影响反应速率的因素及物质鉴别等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 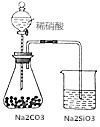 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)>c(Cl-)>c ( NO3-) | B. | c(Ca2+)>c ( NO3-)>c (Cl-) | ||
| C. | c(NO3-)>c ( Ca2+ )>c ( Cl-) | D. | c ( Cl-)>c(Ca2+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若x>z则a>b | B. | x=y>z 则a<b | C. | x=z<y则a=b | D. | x<z=y则a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是氧化还原反应都有利于生产、生活 | |
| B. | 常温下,钠与氧气的反应属于氧化还原反应,故化合反应都属于氧化还原反应 | |
| C. | 切开金属钠,表面迅速变暗是因为钠与氧气反应,故Na在该反应中作氧化剂 | |
| D. | 反应3S+6NaOH═2Na2S+Na2SO3+3H2O中,S既是氧化剂又是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com