
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| D. | 元素电负性越大的原子,吸引电子的能力越强 |
分析 A.铍和铝处于对角线上,所以铍和铝的性质具有相似性;
B.含有孤电子对和含有空轨道的原子之间易形成配位键;
C.甲烷中C-H键键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°;
D.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强.
解答 解:A.铍和铝处于对角线上,根据对角线规则,所以铍和铝的性质具有相似性,故A不选;
B.H3O+中一个H原子含有空轨道、O原子含有孤电子对,所以该微粒中含有配位键,NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B不选;
C.CH4是正四面体分子,碳原子处在正四面体的中心,键角都为109°28ˊ,P4是正四面体分子,磷原子处在正四面体的顶点,键角都为60°,故C选;
D.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强,故D不选;
故选C.
点评 本题考查物质结构有关知识,涉及元素电负性、配位键和键角等相关知识,题目难度不大,甲烷中C-H键键角为109°28ˊ;白磷分子中四个P原子位于四个顶点上键角为60°为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的气体,其气体分子物质的量也相等 | |
| B. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4-二甲基丁烷 | B. | 2,3,3-三甲基丁烷 | ||
| C. | 2-乙基-1-戊烯 | D. | 2,2,3-三甲基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性强弱:F->Cl->I- | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 稳定性强弱:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数相同,互为同位素 | |
| B. | 质子数相同,互为同位素 | |
| C. | 中子数相同,属同一种元素的不同核素 | |
| D. | 核外电子数相同,中子数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
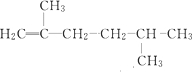 ;
;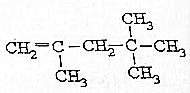
 ;
; →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
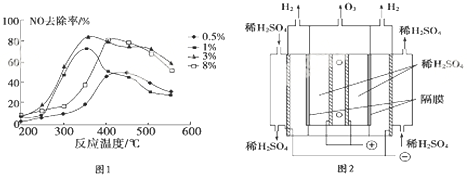
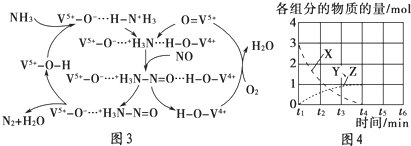
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com