
| A. | 氯离子结构示意图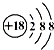 | B. | HCl的电子式 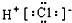 | ||
| C. | CO2的结构式 O=C=O | D. | 作为相对原子质量标准的原子614C |
分析 A.氯离子的核电荷数为17,核外电子总数为18;
B.氯化氢为共价化合物,分子中含有1个H-Cl键;
C.由最外层电子及形成8电子稳定结构可知,存在C=O;
D.作为相对原子质量标准的原子为C-12.
解答 解:A.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为: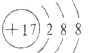 ,故A错误;
,故A错误;
B.氯化氢分子中存在1个氢氯键,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ,故B错误;
,故B错误;
C.由最外层电子及形成8电子稳定结构可知,存在C=O,则CO2分子的结构式O=C=O,故C正确;
D.作为相对原子质量标准的原子为612C,故D错误.
故选C.
点评 本题考查化学用语,涉及电子式、结构式、结构示意图以及原子表示方法等,综合性较强,注重基础知识的考查,把握化学用语的区别及规范应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Y2->Z+ | |
| B. | 气态氢化物稳定性:HW>H2R | |
| C. | XW4分子中各原子均满足8电子稳定结构 | |
| D. | Y、Z、R三种元素组成的化合物只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
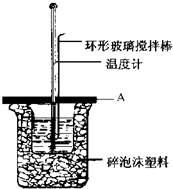 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
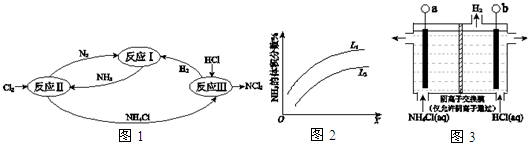
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
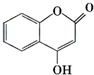 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: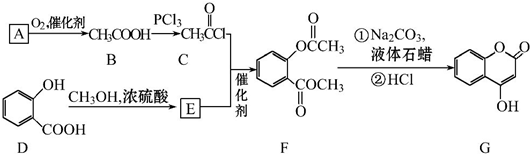
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com