
【题目】下列有关物质的性质与用途具有对应关系的是
A.稀硫酸有酸性,可用于除去铁锈
B.Al2O3具有两性,可用于电解冶炼铝
C.SO2能使酸性高锰酸钾溶液褪色,可用于漂白有色物质
D.甲醛溶液能使蛋白质发生变性,可用于动物标本的防腐
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】取一定量硫酸亚铁和硫酸铁混合物样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·L-1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸亚铁物质的量是___。
(2)在第一份溶液完全反应后的溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤后,在空气中充分灼烧,得到残渣的质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
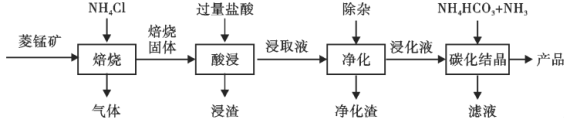
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
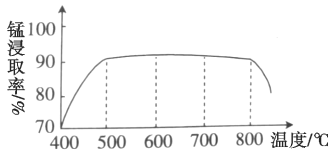
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、E、H是生活中常见的有机物,H常用于食品包装,A的产量是石油化工发展水平的标志。根据如图转化关系回答问题:
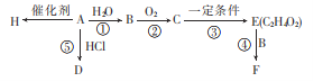
(1)写出A和F中官能团的名称:A___,F___。
(2)反应①、④的反应类型分别为___、___。
(3)写出D和E的结构简式:D___、E___。
(4)请写出下列反应的化学方程式:
I.写出反应②在催化剂存在的条件下并加热的化学方程式:___。
II.A→H的化学方程式:___。
(5)H是一种常见的高分子材料,由这种材料造成的环境问题是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为__,3d能级上的未成对的电子数为__。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为__,提供孤电子对的成键原子是__。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是__;氨是__分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__。
(3)单质铜及镍都是由__键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
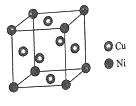
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg/cm3,晶胞参数a=__nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
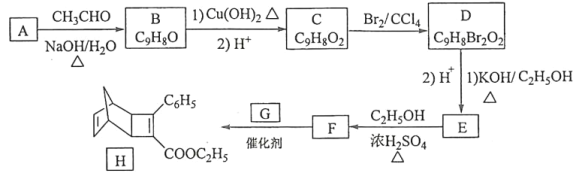
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
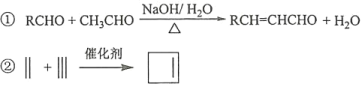
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物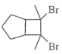 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的反应:3H2 (g)+N2 (g) ![]() NH3 (g),达到限度的标志是( )
NH3 (g),达到限度的标志是( )
A.H2、N2、NH3的分子个数之比为3:1:2B.N2的正反应速率和逆反应速率相等
C.反应已经停止D.单位时间内生成3mol H2,同时生成1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.55mol/LNaOH溶液和0.50mol/LHCl溶液进行中和热的测定。测定中和热的实验装置如图所示。
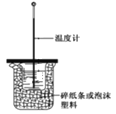
(1)从实验装置上看,图中缺少的一种玻璃仪器__________。
(2)使用补全仪器后的装置进行实验,取50mL0.50mol/LHCl溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,实验数据如表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①请填写表中的空白:温度差平均值__________℃
②上述实验数值结果比中和热57.3kJ/mol偏小,产生的原因可能是______。(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
(3)实验中若用60mL0.25mol/LH2SO4溶液跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”、“不相等”),所求中和热______(填“相等”、“不相等”),若用50mL0.50mol/L醋酸代替HCl溶液进行上述实验,测得反应前后温度的变化值会______(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com