
气态氯化铝分子以双聚形式存在,其结构式如下所示,其中Cl→Al表示Cl原子提供一对电子与Al原子共享.又已知硼酸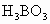 为白色固体,溶于水显弱酸性,但它只是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个方程式右端的两种离子的表达式:
为白色固体,溶于水显弱酸性,但它只是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因,请写出下面这个方程式右端的两种离子的表达式: .
.

科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:022
已知气态氯化铝分子以双聚形式存在,其结构式为: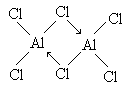 已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因.请写出下面这个方程式右端的两种离子的表达式.
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因.请写出下面这个方程式右端的两种离子的表达式.
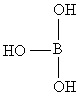 +H2O
+H2O![]() ________+________
________+________
查看答案和解析>>
科目:高中化学 来源: 题型:022
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示:
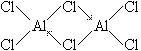
图中“Cl →Al”表示Cl原子提供了一对电子与Al原子共享。又,已知硼酸H3BO3为白色固体, 溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式:

查看答案和解析>>
科目:高中化学 来源: 题型:022
已知气态氯化铝分子以双聚形式存在,其结构式如右图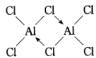 所示.图中“Cl→
所示.图中“Cl→
Al”表示Cl原子提供了一对电子与Al原子共享.又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸.可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因.
(1)请写出下面这个方程式右端的两种离子的表达式:
![]()
![]() ________+________.
________+________.
(2)化工行业合成了一种原子晶体——氮化碳,推测其化学式为________,其硬度比金刚石________,因为_____ ___.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示:

图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享,又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式:
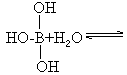 ______+______
______+______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com