
 苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| c(C8H10) |
| c(C8H8)c(H2) |
| ||
| 20min |
| c(C8H8)?c(H2) |
| c(C8H10) |
| 0.08×0.08 |
| 0.12 |
| 消耗量 |
| 起始量 |
| 0.24mol |
| 0.4mol |
| 1 |
| 0.053 |
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.12 |
| 0.08×0.08 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B、NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C、FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、相同条件下,结合质子的能力:OH->AlO2->CO32->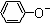 >HCO3->CH3COO- >HCO3->CH3COO- |
B、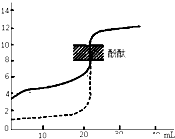 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
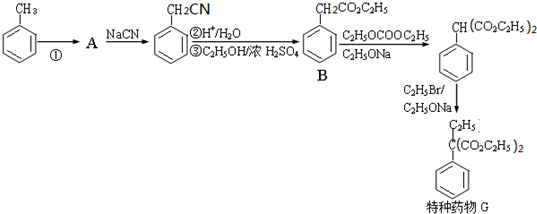
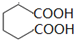 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).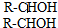
| pb(OAc)4 |
| H2/催化剂 |
| 加热加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
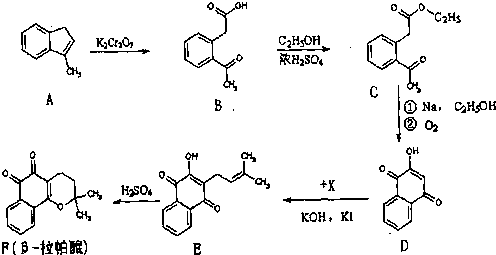
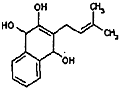 ,写出此有机物分子中含有的官能团名称:
,写出此有机物分子中含有的官能团名称: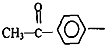 结构且能水解的所有同分异构体的结构简式:
结构且能水解的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
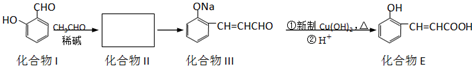
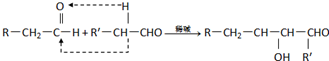
查看答案和解析>>
科目:高中化学 来源: 题型:

| HCl |
| △ |
| O2/Cu |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发皿可用来研磨块状固体物质 |
| B、锥形瓶作为反应容器时一定不能加热 |
| C、分液漏斗不宜盛装碱性溶液 |
| D、可用湿润的蓝色石蕊试纸检测氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com