
分析 有X、Y、Z三种元素:(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色,说明是氢气在氯气中燃烧生成氯化氢,X为H2,Z为Cl2,生成XZ为HCl;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红,说明Z是HCl,溶于水形成盐酸溶液;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体判断为H2O,所以Y为O;
(5)Z单质溶于X2Y中所得溶液具有漂白性,是Cl2溶于H2O中反应生成HCl和HClO,HClO具有漂白作用,据此进行解答.
解答 解:有X、Y、Z三种元素:(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色,说明是氢气在氯气中燃烧生成氯化氢,X为H2,Z为Cl2,生成XZ为HCl;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红,说明Z是HCl,溶于水形成盐酸溶液;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体判断为H2O,所以Y为O;
(5)Z单质溶于X2Y中所得溶液具有漂白性,是Cl2溶于H2O中反应生成HCl和HClO,HClO具有漂白作用,
根据分析可知,X为H,Y为O,Z为Cl,XZ为HCl,X2Y为H2O,
故答案为:H;O;Cl;HCl;H2O.
点评 本题考查位置结构与性质关系的综合应用,题目难度不大,注意根据物质的颜色、状态作为推断的突破口,旨在考查学生对基础知识的积累与熟练程度.


科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
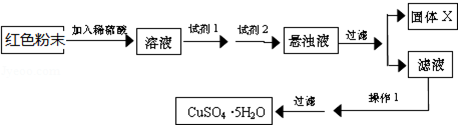
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时溶液可能为中性 | |
| B. | 此时溶液中NH4+的浓度一定增大 | |
| C. | 此时NH4+的水解程度一定增大 | |
| D. | 此过程中,溶液中NH3•H2O和NH4+的数目之和一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 样品中只含一种杂质NaHCO3 | B. | 样品中含有KCl,不含有NaHCO3 | ||
| C. | 样品中含有Ba(NO3)2和NaHCO3 | D. | 样品中含有KCl和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +283.5 kJ•mol-1 | B. | -172.5 kJ•mol-1 | C. | +172.5 kJ•mol-1 | D. | -504 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com