
分析 (1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)设转化的水为amol,根据平衡常数进行计算.
解答 解:(1)①C(s)+H2O(g)?CO(g)+H2(g),
A.反应前后气体的体积不等,故容器内的压强不变可作为判断是否达到化学平衡状态的依据,故A正确;
B.消耗水蒸气是正反应,生成CO也是正反应,故消耗水蒸气的物质的量与生成CO的物质的量相等不能作为判断是否达到平衡状态的依据,故B错误;
C.密度=$\frac{质量}{体积}$,总质量在变,体积不变,故混合气的密度不变可作为判断是否达到化学平衡状态的依据,故C正确;
D.单位时间有n个H-O键断裂是正反应,同时有n个H-H键断裂是逆反应,但正逆反应速率不等,故单位时间有n个H-O键断裂的同时有n个H-H键断裂不能作为判断是否达到平衡状态的依据,故D错误,
故答案为:AC;
(2)C(s)+H2O(g)?CO(g)+H2(g),
开始(mol):6 0 0
转化(mol):a a a
平衡(mol):6-a a a
K=$\frac{a×a}{6-a}$=1,a=2,故x应满足的条件是:x>2,
故答案为:x>2.
点评 本题考查化学平衡的判断和有关计算知识,属于综合知识的考查,难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
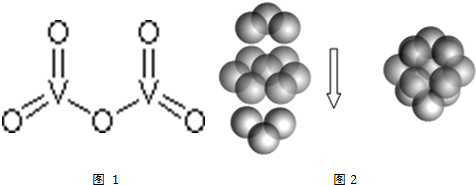
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
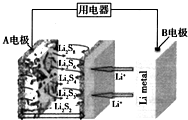
| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
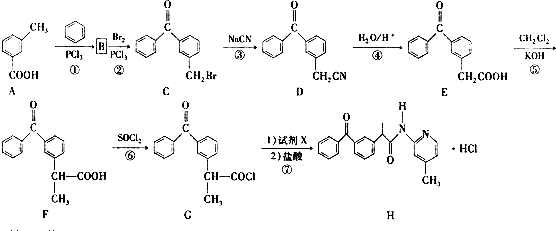
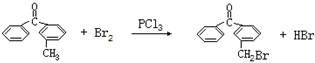 .
.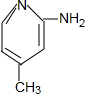 .
.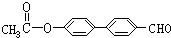 、
、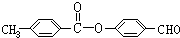
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com