
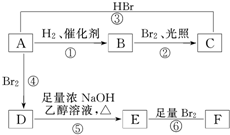
| A、①②③④ | B、④⑤⑥⑧ |
| C、除④⑧外 | D、⑤⑥⑦⑧ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有
(1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有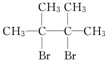
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展植树造林可从头上减少雾霾天气的发生 |
| B、由PM2.5形成的分散系属于胶体,具备胶体的性质 |
| C、加快发展以氢燃料电池为能的电动车,减少燃油车的使用 |
| D、雾霾是由大量燃烧煤、天然气、石油等产生的CO2偏高所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作及现象 | 解释 | |
| A | 在AgI饱和溶液中滴加0.1mol?L-1NaCl溶液,出现白色沉淀 | AgCl的溶解度或Ksp比AgI小,生成更难溶的AgCl沉淀 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeC13溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 将氯气通入紫色石蕊溶液中,溶液先变红,后褪色 | 氯气与水反应生成盐酸和次氯酸,溶液显酸性使石蕊溶液变红,次氯酸具有漂白性,使溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- |
| B、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
| C、水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
| D、能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com