
分析 ①硫与氧气在点燃条件下生成二氧化硫;
②亚硫酸钠与稀硫酸反应生成硫酸钠和二氧化硫、水;
③二硫化亚铁与氧气反应生成二氧化硫和三氧化二铁.
解答 解:①硫与氧气在点燃条件下生成二氧化硫,化学方程式:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
②亚硫酸钠与稀硫酸反应生成硫酸钠和二氧化硫、水,化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
③二硫化亚铁与氧气反应生成二氧化硫和三氧化二铁,化学方程式:4FeS2+11O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+8SO2;
故答案为:4FeS2+11O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+8SO2;
点评 本题考查了化学方程式的书写,明确硫及其化合物性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子的球棍模型图: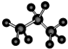 | B. | TNT的分子式:C7H5N3O6 | ||
| C. | 乙烯分子的比例模型: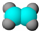 | D. | 苯乙醛的结构简式: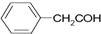 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
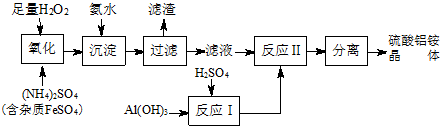
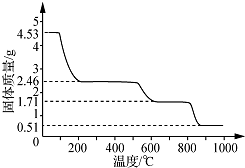
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐及氧化物都是电解质 | |
| B. | 电解质溶液能导电是因为发生了电离,产生了自由移动的离子 | |
| C. | 电解质不一定能导电,能导电的物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 品红溶液褪色 | B. | AgNO3溶液产生沉淀 | ||
| C. | BaCl2溶液产生沉淀 | D. | 石蕊试液变红 |
查看答案和解析>>
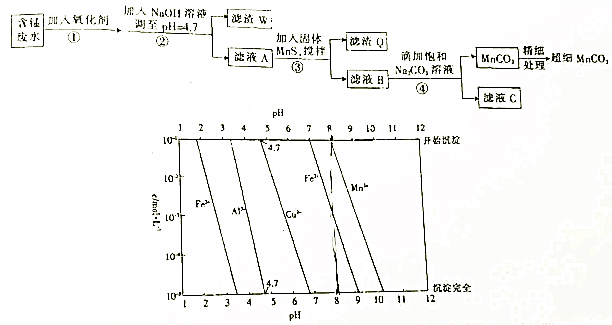
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:填空题
根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
在1L含0.2molKOH、0.1molNaAlO2和0.1 mol Ba(NO3) 2 的混合溶液中,逐滴加入浓度为0.1 mol/L 的H 2 SO 4 溶液,下列图像中能表示反应产生的沉淀的物质的量和所加入硫酸溶液的体积关系是(已知AlO2-和Ba2+可以大量共存)

查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:实验题
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。
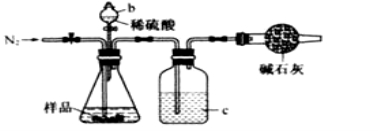
(1)甲同学用上图所示装置测定CO2的质量。实验时稀硫酸是与样品中的_________(填“Na2CO3”或
"NaCl”)发生反应。仪器b的名称是_____________。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________。
(2)乙同学用下图所示方法和步骤实验:

①操作I涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、___________。
②乙测得的样品中Na2CO3质量分数的计算式为___________________。
(3)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com