
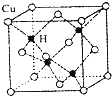
 (1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为
(1)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
| A、第ⅠA族的元素都为金属元素 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、过渡元素全部是金属元素 |
| D、周期表中有7个主族,7个副族,一个0族,一个Ⅷ族,共16个族16个纵行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4mL蒸馏水 | 4mL 蒸馏水 +3滴浓H2SO4 |
4mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2mL乙酸乙酯 |
3滴甲基橙试剂 2mL乙酸乙酯 |
3滴石蕊溶液 2mL乙酸乙酯 |
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4mL饱和食盐水 | 4mL饱和食盐水 +3滴浓H2SO4 |
4mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2mL乙酸乙酯 |
3滴甲基橙试剂 2mL乙酸乙酯 |
3滴石蕊溶液 2mL乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com