
【题目】研究金属与硝酸的反应,实验如下。
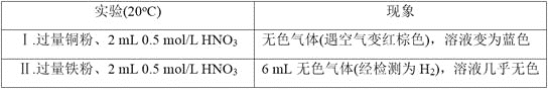
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________________________________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是_______________________________。
②乙同学通过分析,推测出NO3-也能被还原,依据是___________________________,进而他通过实验证实该溶液中含有NH4+,其实验操作是__________________________
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有_________________________试推测还可能有哪些因素影响_________(列举1条)。
【答案】NO或一氧化氮 Fe+2H+===Fe2++H2↑ 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出 NO3- 中氮元素的化合价为最高价,具有氧化性 取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 金属的种类、硝酸的浓度 温度
【解析】
(1)铜与硝酸反应生成无色气体,该气体与空气变红,故该气体是NO;
(2)Ⅱ中铁与硝酸溶液中的H+发生氧化还原反应生成H2;
(3)①如果硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化为铜离子;
②元素化合价处于最高价,具有氧化性,NH4+的检验可以与浓的氢氧化钠溶液在加热的条件下反应,产生的气体通过湿润的红色石蕊试纸来检验;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素是金属活泼性、硝酸的浓度、温度。
(1)铜与硝酸反应生成无色气体,该气体与空气变为红棕色,故该气体为NO,红棕色的气体为NO2;
(2)Ⅱ中铁与硝酸溶液中的H+发生氧化还原反应生成H2,离子反应方程式为:Fe+2H+=Fe2++H2↑;
(3)①如果硝酸根离子没有发生反应,则Ⅰ溶液不会变蓝,溶液变蓝说明铜被氧化为铜离子,其实验证据是硝酸浓度相同,铜的还原性比铁的还原性弱,但Ⅰ中溶液变蓝,同时没有氢气放出;
②元素化合价处于最高价,具有氧化性,NO3-中氮元素的化合价为最高价,具有氧化性,被还原;
NH4+的检验可以与浓的氢氧化钠溶液在加热的条件下反应,产生的气体通过湿润的红色石蕊试纸来检验,具体操作为:取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体;
(4)金属与硝酸反应时,影响硝酸还原产物不同的因素是金属活泼性、硝酸的浓度、温度。


科目:高中化学 来源: 题型:
【题目】实验室可通过反应:3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
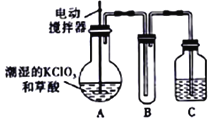
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_____。
(2)请分析装置图,进行补充和完善。A部分缺________装置,B部分还应补充_______装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离子方程式____。
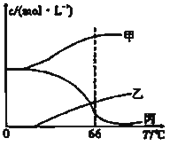
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是__________、__________、__________(不考虑Cl2的挥发)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.将1mol氯化铁完全溶于水制成胶体,其中所含胶体粒子数目小于NA
B.标准状况下22.4 L HF中含有的氟原子数目为NA
C.常温下,2.8g C2H4与C3H6的混合物中共价键数为0.6NA
D.1L含NA个Al3+的Al(NO3)3液中,NO3-物质的量浓度大于3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是

A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)泡沫灭火器原理(用离子方程式表示)___________
(2)碳酸钠溶液蒸干灼烧得到的固体是_____, 原因是____________
(3)已知NaHR溶液中c(H2R)<c(R2-),则该溶液中c(H+)________c(OH-)(填写“<”或“=”或“>”)
(4)相同条件下,同浓度的NH3H2O , NH4Cl,NH4Al(SO4)2,NH4HSO4水溶液,NH4+浓度分别为a,b,c,d,则几种物质NH4+浓度由大到小的顺序为_______ (用a,b,c,d,表示)
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常做脱水剂。用硫磺(用S表示)、液氯和三氧化硫为原料在一定条件下合成二氯亚砜,原子利用率达到百分之百,则三者的物质的量之比为____________ 写出SOCl2吸收水蒸气的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组设计如图所示装置分别进行如下探究实验,请回答下列问题:
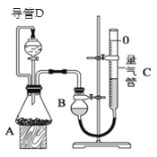
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | Na OH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是__________________________;
(2)实验Ⅱ中量气管中的液体最好是_______(填字母编号,下同)
A.NaOH溶液B.氨水C.煤油D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是________;
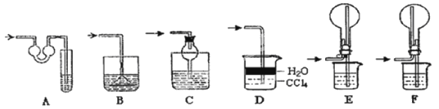
(3)①写出实验Ⅲ中涉及的离子反应方程式_________________________;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是________________,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备、收集干燥的![]() ,所需仪器如图:
,所需仪器如图:
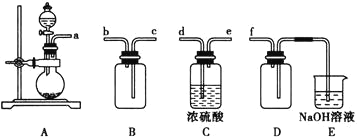
(1)写出实验室制取SO2的化学方程式__________
(2)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→_____→____→_____→____→f。
(3)装置D的作用是______,装置E中NaOH溶液的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
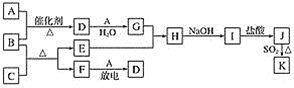
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com