
 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).分析 (1)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(2)氯水中含有盐酸,盐酸能够与碳酸钙反应;
(3)氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡移动;
(4)依据反应产物中有HClO、Ca(HCO3)2、CaCl2,书写化学方程式;
(5)因为K1(H2CO3)>Ka(HClO)>K2(H2CO3),所以少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3;
解答 解:(1)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)氯水中含有盐酸,向盛有饱和氯水的烧杯中加入碳酸钙,盐酸能够与碳酸钙反应生成氯化钙和二氧化碳、水,现象为:固体碳酸钙溶解,有气泡冒出;
故答案为:碳酸钙溶解,有气泡冒出;
(3)氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡正向移动,提高氯水中HClO的浓度;
故答案为:氯水中存在Cl2+H2O?HCl+HClO,HCl与碳酸钙反应,促进平衡正向移动;
(4)根据实验(1)-(4)实验步骤发生的反应和物质判断可知氯水和碳酸钙反应的化学方程式为2CaCO3+2Cl2+2H2O=CaCl2+Ca(HCO3)2+2HClO,
故答案为:2CaCO3+2Cl2+H2O=CaCl2+Ca(HCO3)2+2HClO;
(5)Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3,化学方程式:CO2+NaClO+H2O=NaHCO3+HClO,
故答案为:CO2+NaClO+H2O=NaHCO3+HClO;
点评 本题通过氯气的制备考查了氯气、次氯酸的性质,涉及离子方程式书写、化学方程式的书写、化学平衡移动的影响因素,明确弱酸电离平衡常数与酸的强度是解题关键,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳碳双键 | |
| B. | 易被酸性KMnO4溶液氧化 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 在一定条件下可与浓硝酸和浓硫酸的混合酸反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增大O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
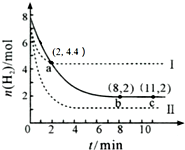
| A. | 该温度下,a点时,3 v正(CO2)=v正(H2) | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 曲线Ⅰ对应的条件改变可能是降低温度 | |
| D. | 从反应开始至a点,v (CO2)=0.6 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com