
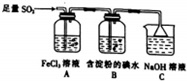
分析 I.(1)二氧化硫具有还原性能与单质碘发生氧化还原反应;二氧化硫是有毒气体,要进行尾气处理;
(2)①三价铁离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
II.(3)CrO42-有强氧化性,S2O32-有还原性,S2O32-能被氧化生成SO42-,同时CrO42-被还原生成铬离子,根据氧化还原反应中得失电子数相等及原子守恒配平方程式,据此写出离子反应方程式;
(4)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可.
解答 解:I.(1)二氧化硫具有还原性能与单质碘发生氧化还原反应,所以把二氧化硫通入含有淀粉的碘水中,溶液的蓝色会褪去;二氧化硫是有毒气体,直接排入空气会产生污染,所以要用NaOH溶液进行尾气处理;
故答案为:溶液蓝色褪去;吸收尾气中的二氧化硫,防止污染空气;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,
故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
II.(3)CrO42-有强氧化性,S2O52-有还原性,S2O52-能被氧化生成SO42-,同时CrO42-被还原生成铬离子,由氧化还原反应中得失电子数相等及原子守恒配平方程式为4CrO42-+3S2O52-+14H+=4Cr3++6SO42-+7H2O,则该反应中氧化剂与还原剂的物质的量之比为4:3;
故答案为:4:3;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成.
点评 本题考查性质实验方案的设计及实验装置综合,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、S的还原性依次增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
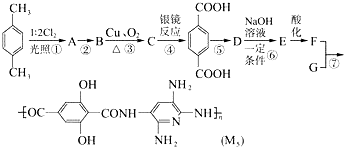
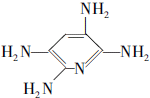 ,F的含氧官能团的名称有羧基、(酚)羟基.
,F的含氧官能团的名称有羧基、(酚)羟基.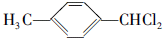 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
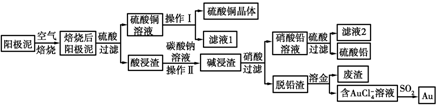
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | |
| B. | 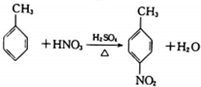 | |
| C. | 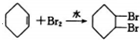 | |
| D. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有18列,即18个族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1~20号元素 | |
| D. | 原子的种类和元素的种类一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
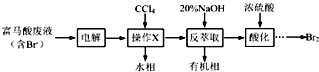

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com