分析:(1)通过图表数据计算一氧化碳变化物质的量,结合化学方程式计算消耗氢气的物质的量,依据反应速率概念计算V=
计算得到;
(2)依据一氧化碳消耗量放出的热量,计算1mol一氧化碳完全燃烧放出的热量,标注物质聚集状态和对应反应的焓变书写热化学方程式;
(3)化学平衡状态是正逆反应速率相同,各组分含量保持不变,及其衍生的量的变化判断;
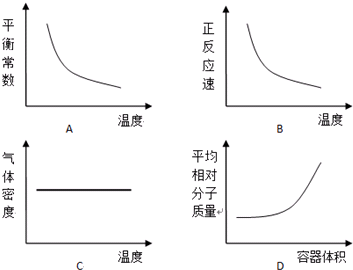
(4)反应是吸热反应,升温平衡逆向进行,平衡常数减小;温度升高反应速率增大,气体质量不变,容器体积不变,混合气体密度不变,所以气体密度不变;反应前后气体体积不变,气体质量守恒,混合气体摩尔质量不变;
(5)依据图表数据分析,t
2时刻水消耗物质的量为0.40mol,消耗一氧化碳0.40mol,最后剩余一氧化碳物质的量为0.80mol,说明t1时刻达到平衡状态,此时反应平衡常数可以依据物质的量代替平衡浓度计算平衡常数,结合平衡常数计算分析
解答:
解:(1)图表数据计算一氧化碳变化物质的量=1.20mol-0.80mol=0.40mol,消耗氢气物质的量依据化学方程式计算可知为0.40mol,反应速率=
=
mol?L
-1?min
-1;
故答案为:
mol?L
-1?min
-1;
(2)依据图表分析,消耗一氧化碳物质的量0.40mol放热QKJ,则消耗1mol一氧化碳反应放热2,5QKJ,反应的热化学方程式为:CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-2.5QkJ/mol;
故答案为:CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-2.5QkJ/mol;
(3)CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H<0
A.反应前后气体体积不变,容器的压强始终不发生变化,不能说明反应达到平衡状态,故A错误;
B.断裂2mol O-H反应正向进行,同时消耗1mol H-H说明费用逆向进行,且正逆反应速率相同,说明反应达到平衡状态,故B正确;
C.v(CO)
正=v(CO
2)
正,反应速率之比等于化学方程式计量数之比,是正反应速率之比,不能说明反应达到平衡状态,故C错误;
D.反应前后气体物质的量不变,气体质量不变,反应过程中和平衡状态下气体的平均分子量始终不变化,不能说明费用达到平衡状态,故D错误;
故答案为:B;
(4)A、反应是吸热反应,升温平衡逆向进行,平衡常数减小,图象符合不饱和过程,故A正确;
B、温度升高反应速率增大,正逆反应速率都增大,故B错误;
C、气体质量不变,容器体积不变,混合气体密度不变,所以图象表示的是气体密度不变,故C正确;
D、反应前后气体体积不变,气体质量守恒,混合气体摩尔质量不变,图象不正确,故D错误;
故答案为:AC;
(5)依据图表数据分析,t
2时刻水消耗物质的量为0.40mol,消耗一氧化碳0.40mol,最后剩余一氧化碳物质的量为0.80mol,说明t1时刻达到平衡状态,此时反应平衡常数可以依据物质的量代替平衡浓度计算平衡常数,平衡常数K=
=1,结合平衡常数计算分析,设消耗一氧化碳浓度x
CO(g)+H
2O(g)?CO
2(g)+H
2(g)
起始量(mol/L) 0.2 0.3 0 0
变化量(mol/L) x x x x
平衡量(mol/L)0.2-x 0.3-x x x
K=
=1
x=0.12,则a=0.08mol/L,b=0.18mol/L,c=0.12mol/L,d=0.12mol/L
故答案为:BC;



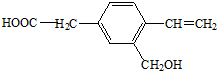 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: