
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是( )
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
C
【解析】
试题分析:A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,根据物质的化学式判断氯化铵的浓度最大, (NH4)2Fe(SO4)2中亚铁离子的水解对铵根离子的水解起抑制作用,所以(NH4)2SO4的浓度稍大,所以溶质浓度大小关系是c(NH4Cl) ﹥c[(NH4)2SO4]﹥c[(NH4)2Fe(SO4)2],正确;B、在0.1mol·L-1AlCl3溶液中氯离子的浓度是0.3mol/L, 根据Ksp(AgCl)=1.8×10-10,可知Ag+的物质的量浓度最大可达到Ksp(AgCl)/0.3mol/L=6.0×10-10mol·L-1,正确;C、0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的氢离子浓度是0.05mol/L,pH不约为1,错误;D、室温下,0.1mol·L-1NaHA溶液的pH=4,说明该溶液显酸性,则HA-电离程度大于水解程度,所以C(HA-) >C(H+)>C(A2-)>C(H2A),正确,答案选C。
考点:考查溶液中离子浓度的比较


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:选择题
金属M和N可构成如图所示的装置.下列分析正确的是
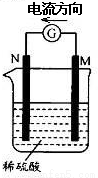
A.金属活泼性N>M
B.M逐渐溶解
C.负极反应为2H++2e- =H2↑
D.SO42-向M极定向移动
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
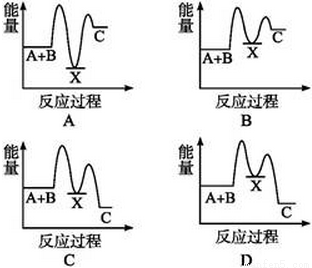
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
下列各组物质的燃烧热相等的是( )
A.碳和一氧化碳
B.1 g碳和2 mol碳
C.淀粉和纤维素
D.3 mol乙炔(C2H2)和1 mol苯(C6H6)
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:
(1)写出合成甲醇反应的热化学方程式 ;
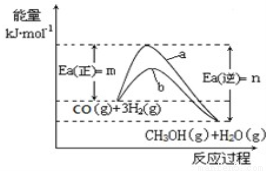
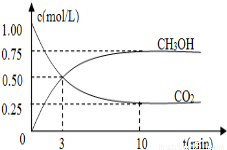
图1 图2
(2)在图中曲线 (填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值 (填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________ 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________ 。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是( )
A.原子序数:A>C>B>DB.单质熔点:D>B, A>C
C.原子半径:D>B>C>AD.简单离子半径:D>B>C>A
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是 ( )

A.实验Ⅰ:制备金属钠 B.实验Ⅱ:制取氢氧化亚铁并观察其颜色
C.实验Ⅲ:制取少量的氢氧化铝 D.实验Ⅳ:比较两种物质的热稳定性
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.往待测液中滴加氯水,然后滴加KSCN溶液,以检测待测液中是否含有Fe2+
B.往待测液中滴加BaCl2,然后滴加盐酸,以检测待测液中是否含有SO42-
C.蒸馏操作时应将温度计的水银球插入液面下
D.向试管中加入5mL SO2水溶液,然后滴加BaCl2溶液,再滴加3%的H2O2溶液,以检测SO2具有还原性
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:填空题
)如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)

回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com