
设NA为阿伏加德罗常数,下列叙述中,正确的是
A.标准状况下,NH3和CH4的混合气体2.24L,所含电子总数为2NA
B.7g CnH2n中含氢原子数为NA
C.78 g 过氧化钠与CO2反应,转移电子数为2NA
D.25℃时,0.1mol/L的NaOH溶液中,含有钠离子数为0.1NA
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Z>Y
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:填空题
(8分)工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去。下图为电解装置示意图(电极材料分别为铁和石墨):
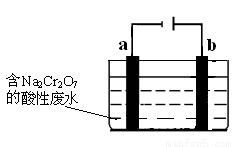
请回答:
(1)装置中的b电极是 (填“阳极”或“阴极”)。
(2)a电极的电极反应式是 。
(3)完成b电极附近溶液中反应的离子方程式:
Cr2O72-+6Fe2++14H+=2 +6 +7
(4)电解时用铁不用石墨做阳极的原因是 。
(5)电解结束后,若要检验电解液中还有Fe2+存在,可选用的试剂是 (填字母)。
A.KSCN溶液 B.CuCl2溶液 C.H2O2溶液 D.K3[Fe(CN)6]
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,22.4 L O2含有的分子数为NA
B.常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA
C.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol·L-1
D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:填空题
(7分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)这三种氧化物中,属于酸性氧化物的是____________(用化学式表示)。
(2)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+8NH  7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 196.6 kJ·mol-1
2SO3(g) ΔH1= - 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2= - 113.0 kJ·mol-1
2NO2(g) ΔH2= - 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应:
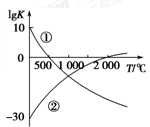
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+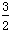 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
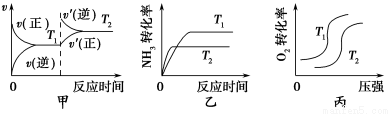
②该燃料电池的负极反应式是____________________________________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
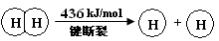

下列说法不正确的是
A.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l) ΔH <-241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量的关系图:
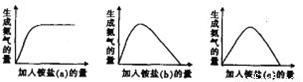
下列判断不正确的是:
A.a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C.c对应的铵盐是NH4HSO4
D.当b和c铵盐的质量相同时,可得到相同质量的氨气
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列对实验现象的预测不正确的是
A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失
B.向Na2CO3饱和溶液中通入CO2,溶液变浑浊,继续通入CO2,有晶体析出
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com