
【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。
【答案】 ![]() HClO4 Cl->Na+>Mg2+ Mg(OH)2<NaOH<KOH Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Br-=2Cl-+Br2
HClO4 Cl->Na+>Mg2+ Mg(OH)2<NaOH<KOH Al+2NaOH+2H2O=2NaAlO2+3H2↑ Cl2+2Br-=2Cl-+Br2
【解析】首先根据元素在周期表中的位置判断出元素名称,然后结合元素周期律以及有关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~⑧分别是N、Na、Mg、Al、Si、K、Cl、Br。则
(1)元素③是镁,原子结构示意图是![]() ;非金属性越强,最高价含氧酸的酸性越强,则以上元素的最高价氧化物形成的水化物酸性最强的是HClO4。
;非金属性越强,最高价含氧酸的酸性越强,则以上元素的最高价氧化物形成的水化物酸性最强的是HClO4。
(2)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为Cl->Na+>Mg2+;金属性越强,最高价氧化物水化物的碱性越强,则②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是Mg(OH)2<NaOH<KOH。
(3)元素②的单质与水反应后的溶液是氢氧化钠溶液,加入元素④的单质铝,发生反应的化学方程式为Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(4)氯气能把溴离子氧化为单质溴,说明氯元素非金属性强于溴元素,反应的离子方程式为Cl2+2Br-=2Cl-+Br2。


科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的.利用已学知识对下列实验进行分析并填空:
Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成同主族元素C、Si非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.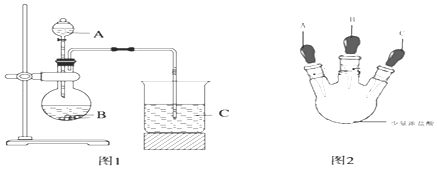
(1)甲同学设计实验所涉及的离子方程为:、 .
(2)乙同学具体操作如下:
①先挤压胶头滴管A,使少量溶液滴入烧瓶内;
②挤压胶头滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为 .
③再挤压胶头滴管C,使少量溶液滴入烧瓶内,可观察到;
(3)根据甲乙同学的实验可得到的结论是:
(4)II.
实验 |
| ||
实验 |
|
|
|
实验 | 结论: | ||
反应 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气﹣锌电池的电极反应为:锌片:Zn+20H﹣﹣2e﹣=ZnO+H20,石墨:02+2H20+4e﹣=40H﹣ . 根据此判断,锌片是( )
A.负极,并被氧化
B.负极,并被还原
C.正极,并被氧化
D.正极,并被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如图. 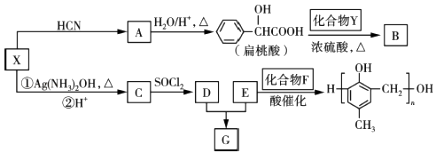
已知以下信息:
①RCHO ![]()
![]() RCHO
RCHO ![]()
![]()
②RCOOH ![]()
![]()
![]() RCOOR'(R、R'代表烃基)
RCOOR'(R、R'代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y.
④化合物F的核磁共振氢谱图中只有一个吸收峰.
回答下列问题:
(1)X中含氧官能团的名称是 , X与HCN反应生成A的反应类型是 .
(2)酯类化合物B的分子式是C15H14O3 , 其结构简式是 .
(3)X发生银镜反应的化学方程式是 .
(4)G在NaOH溶液中发生水解反应的化学方程式是 .
(5)![]() 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位.满足上述条件的同分异构体共有种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式: .
(6)写出以C2H5OH为原料合成乳酸( ![]() )的路线(其他无机试剂任选).合成路线流程图示例如下: CH3CH2Br
)的路线(其他无机试剂任选).合成路线流程图示例如下: CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJmol﹣1
B.500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H=﹣38.6 kJmol﹣1
2NH3(g)△H=﹣38.6 kJmol﹣1
C.稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1
D.1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2>T1),在3个体积均为2.0L的恒容密闭容器中反应2NO(g)+Cl2(g)=2ClNO(g) (正反应放热)达到平衡,下列说法正确的是
容器 | 温度/ (℃) | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(NO) | c(Cl2) | C(ClNO).v | C(ClNO) | ||
Ⅰ | T1 | 0.20 | 0.10 | 0 | 0.04 |
Ⅱ | T2 | .020 | 0.10 | 0.20 | cl |
Ⅲ | T3 | 0 | 0 | 0.20 | C2 |
A. 达到平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1:2
B. 达到平衡时,容器Ⅲ中ClNO的转化率小于80%
C. 达到平衡时,容器Ⅱ中c(ClNO)/C(NO)比容器Ⅰ中的大
D. 若温度为T1,起始时向同体积恒容密闭容器中充入0.20molNO(g).、0.2mo1Cl2(g)和0.20molClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A. X:3s23p2 Y:3s23p5 B. X:2s22p3 Y:2s22p4
C. X:3s23p1 Y:2s22p5 D. X:2s22p3 Y:1s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的硫酸亚铁、较多的Cu2+和较少的Na+以及部分泥沙.为了减少污染并变废为宝,工厂计划从该废水中回收绿矾和金属铜.请根据如图流程图完成实验方案.

(1)操作1的名称___________.所需的玻璃仪器有_____________________
(2)已知试剂1为Fe,试剂2为稀硫酸,则滤渣2所含物质的化学式为__________
(3)在澄清溶液中加入试剂1后发生化学反应,请写出该反应的离子方程式____________.
(4)滤渣1中加入试剂2后发生化学反应,请写出该反应的离子方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com