

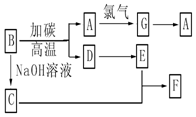
分析 氯碱厂电解饱和食盐水制取烧碱,同时制盐酸,粗盐静止得到精盐溶液电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,氢氧化钠溶液蒸发得到氢氧化钠固体,氯气和氢气反应可以自备盐酸,氯气液化得到液氯,和氢氧化钙反应生成漂白粉,
(1)电解氯化钠饱和溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中生成氢氧化钠;
(2)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极上有氢氧根离子生成,用氯气和消石灰可制得漂粉精是氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水;
(3)为增大氯气的转化率,过量的气体是氢气;氢气在氯气中燃烧产生苍白色火焰;
(4)利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量;
(5)用硝酸酸化的硝酸银溶液检验氯离子.
解答 解:(1)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,所以电池反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)电解饱和食盐水时,与电源正极相连的电极上氯离子失电子发生氧化反应,电极反应式为:发生的反应为2Cl--2e→Cl2,阴极上氢离子得电子生成氢气,用氯气和消石灰可制得漂粉精是氯气和氢氧化钙反应生成次氯酸钙、氯化钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:阴;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)HCl合成反应中保持过量的气体是氢气,氢气在氯气中燃烧产生苍白色火焰,
故答案为:氢气;苍白色火焰;
(4)利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量,
故答案为:充分利用能量;
(5)氯离子的检验方法是:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠,
故答案为:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠.
点评 本题考查了电解池原理、除杂、物质制备、离子检验等知识点,题目难度中等,电解饱和食盐水的原理和反应,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.
CH3COOC2H5+H2O;该反应的有机反应类型是取代(酯化)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 根据表中数据不能计算出混合物中NaHCO3的质量 | |
| B. | 根据表中数据可救出盐酸的物质的量浓度为3mol•L-1 | |
| C. | 加入混合物9.2 g时恰好与盐酸完全反应 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 配制FeSO4溶液时,为抑制Fe2+水解,先将FeSO4固体溶于稀硫酸中,然后稀释至所需浓度 | |
| C. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com