
【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
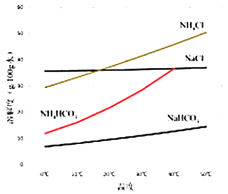
【答案】![]() 随温度升高,平衡总压增大,说明升温平衡正反应方向移动正反应为吸热反应 d
随温度升高,平衡总压增大,说明升温平衡正反应方向移动正反应为吸热反应 d ![]()
![]() d
d ![]() 两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小
两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小 ![]()
【解析】
(1)图表分析可知,随温度升高,平衡总压增大,说明升温平衡正反应方向移动,该反应的正反应为吸热反应,反应中![]() ,
,![]() ;
;
(2)a、根据反应方程式,反应物为固体,产物为气体,反应任何时候,c(NH3)/c(CO2)始终保持不变,即该比值保持保持不变,不能说明反应达到平衡状态,故a不符合题意;
b、没有说明速率的方向,因此不能据此判断是否达到平衡,故b不符合题意;
c、根据反应方程式的特点,混合气体的平均分子质量始终不再变化,不能说明反应达到平衡状态,故c不符合题意;
d、根据密度的定义,反应物为固体,生成物为气体,随着反应进行,气体质量增大,容器为恒容,气体体积不变,因此混合气体的密度不再变化说明反应达到平衡状态,故d正确;
(3)反应中![]() ,根据化学平衡常数的定义,平衡常数
,根据化学平衡常数的定义,平衡常数![]() ;
;![]() 时,反应t分钟后固体的物质的量减少一半,即反应物消耗
时,反应t分钟后固体的物质的量减少一半,即反应物消耗![]() ,生成氨气物质的量为nmol,t分钟内用
,生成氨气物质的量为nmol,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ;
;
(4)a、NH3·H2O为弱电解质,部分电离,NaOH为强碱,完全电离,则两溶液中离子浓度不同,导电能力不同,故a说法正确;
b、一水合氨溶液中存在电离平衡,氢氧化钠为强电解质完全电离,两溶液![]() 不同,故b说法正确;
不同,故b说法正确;
c、溶液中氢氧根离子浓度不同,对水抑制程度不同,两溶液中水的电离程度不同,故c说法正确;
d、水的离子积只受温度的影响,温度不变,则两溶液中水的离子积相同,故d说法错误;
(5)同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,NH4Cl溶液中存在NH4++H2O
溶液中,NH4Cl溶液中存在NH4++H2O![]() NH3·H2O+H+,NH4HCO3属于弱酸弱碱盐,NH4HCO3相当于在NH4Cl溶液中加入HCO3-,促进NH4+的水解,则c(NH4+)最小的是NH4HCO3,其原因是两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小;
NH3·H2O+H+,NH4HCO3属于弱酸弱碱盐,NH4HCO3相当于在NH4Cl溶液中加入HCO3-,促进NH4+的水解,则c(NH4+)最小的是NH4HCO3,其原因是两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小;
(6)25℃时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,溶解后结合溶解度大小,得到析出碳酸氢钠晶体,则溶液中离子浓度最大的是氯离子;
等物质的量的NaCl固体,溶解后结合溶解度大小,得到析出碳酸氢钠晶体,则溶液中离子浓度最大的是氯离子;


科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
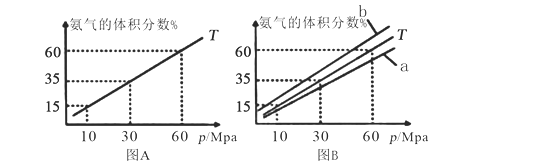
①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
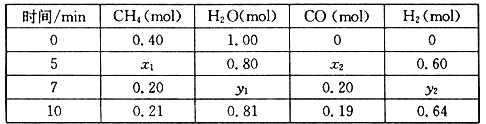
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷可以在氯气中燃烧,产物为PCl3和PCl5
①2P+3Cl2=2 PCl3 ②2P+5Cl2=2 PCl5
(1)若有1mol磷按①式完全反应,得到产物________克,在这些产物中含有共价键的数目为________。
(2)若有12.4g磷与0.90mol氯气同时发生①、②两式反应,反应后磷与氯气均无剩余。计算产物中PCl3和PCl5的物质的量。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJmol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
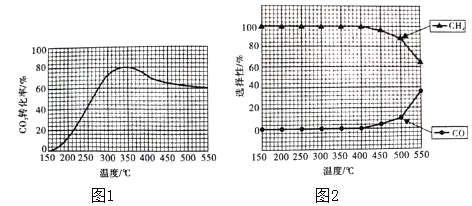
①下列说法不正确的是_____(填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____(用a、V表示)。
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____
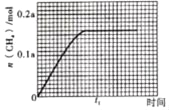
(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() B. 混合液的pH=7
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是
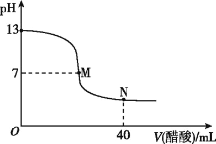
A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙溶于酸,极微溶于水,不溶于乙醇、乙醚和丙酮,通常可用作医用杀菌剂、消毒剂、防腐剂。已知从溶液中制得的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在350℃时会迅速分解生成CaO和O2.以下是一种用纯净的碳酸钙制备过氧化钙的实验方案。请回答下列问题:
CaCO3![]() 滤液
滤液![]()
![]() 白色结晶
白色结晶
(1)步骤①的具体操作为向碳酸钙中逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈_____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是_____。
(2)步骤②中反应的化学方程式为_____,该反应需要在冰浴下进行,原因是_____。
(3)过滤得到的白色晶体先用蒸馏水洗涤,再用乙醇洗涤,使用乙醇洗涤的目的是_____。
(4)过氧化钙在水产养殖方面可以作为释氧剂,也可以作为观赏鱼苗空运的水中添加剂,用化学方程式表示其作用原理_____。
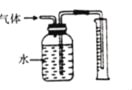
(5)为测定产品中过氧化钙的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过图所示装置收集,测得量筒中水的体积为VmL,则产品中过氧化钙的质量分数为_____(列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g) ![]() 3C(g)+4D(g)中,表示该反应速率最快的是
3C(g)+4D(g)中,表示该反应速率最快的是
A. υ(A)=0.5 mol/(Ls) B. υ(D)=60 mol/(Lmin)
C. υ(C)=0.8 mol/(Ls) D. υ(B)=0.3 mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com