
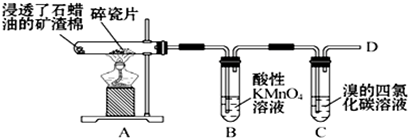
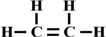 ,空间结构是平面型分子;
,空间结构是平面型分子;分析 ①乙烯分子中含有官能团为碳碳双键,乙烯分子中碳碳原子间是双键,碳原子和氢原子间为单键,分子借故为平面结构;
②乙烯通入氧化剂高锰酸钾溶液中发生氧化反应,溶液紫红色褪去;
③C中通入乙烯和溴单质发生加成反应;
④点燃可燃性气体时应先验纯,乙烯气体燃烧因为含碳量高出现黑烟,出现明亮火焰.
解答 解:①乙烯分子中含有官能团为碳碳双键,乙烯分子中碳碳原子间是双键,碳原子和氢原子间为单键,结构式为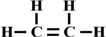 ,分子结构为平面结构,
,分子结构为平面结构,
故答案为:碳碳双键;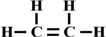 ;平面型分子
;平面型分子
②高锰酸钾具有强氧化性能氧化乙烯生产二氧化碳,所以乙烯通入氧化剂高锰酸钾溶液中发生氧化反应,溶液紫红色褪去,
故答案为:氧化反应;酸性高锰酸钾溶液紫色褪去;
③C中通入乙烯和溴单质发生加成反应,反应的化学方程式为:CH2=CH2+Br-Br→CH2Br-CH2Br,
故答案为:加成反应;CH2=CH2+Br-Br→CH2Br-CH2Br;
④点燃可燃性气体时应先验纯,在D处点燃前必须进行的操作是检验气体的纯度,乙烯气体燃烧因为含碳量高出现黑烟,出现明亮火焰,
故答案为:检验气体的纯度;火焰明亮,伴有黑烟.
点评 本题考查了乙烯的化学性质和结构,题目难度不大,要注意乙烯中含有碳碳双键,有还原性,能使高锰酸钾溶液和溴水褪色,但是反应类型不同.


科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
| 阴离子 | OH-、I-、NO3-、AlO2-、HCO3-、HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO3 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热. | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com