
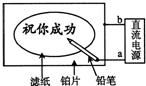
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
分析 此为电解氯化钠溶液的实验装置,电解时的阴极反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,
总反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色,以此回答.
解答 解:A、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,阴极上发生2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,故A错误;
B、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极,故B错误;
C、铅笔做阴极,反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,有氢气产生,故C错误;
D、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,连接电源的负极,即a为负极,则b为正极,故D正确.
故选:D.
点评 本题考查电解原理及应用,题目难度不大,做题时注意从反应的现象判断电解池的阴阳极入手来解答,注意把握电极反应和溶液离子浓度的变化.


科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 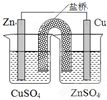 装置能构成锌铜原电池 | |
| C. | 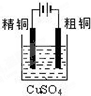 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
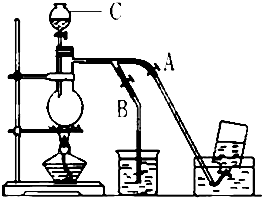 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 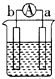 CuSO4溶液 | 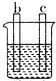 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
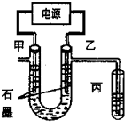 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com